Novo método detecta oxidante biológico derivado de CO2 em células
Pesquisadores do CEPID Redoxoma liderados pela professora Ohara Augusto, do Instituto de Química da USP, revelaram um novo método para detectar peroximonocarbonato em células, baseado no uso de sondas moleculares fluorescentes. O peroximonocarbonato é um oxidante biológico produzido pela reação entre peróxido de hidrogênio (H2O2 ou água oxigenada) e dióxido de carbono (CO2). Essa é a primeira vez que o oxidante é detectado em células.
“Atualmente, se acumulam evidências de que o peroximonocarbonato é importante tanto nas respostas adaptativas das células, que é sinalização redox, quanto nas disfunções celulares. Por outro lado, também há evidências epidemiológicas de que os níveis de CO2 que estamos perto de atingir nas sociedades contemporâneas urbanas causam uma série de problemas fisiológicos. E os mecanismos de toxicidade do CO2 ainda são pouco conhecidos. Então esse trabalho é importante não apenas por fornecer um método para mostrar que o peroximonocarbonato está sendo produzido numa série de condições, inclusive celulares, mas também para discuti-lo, considerando a pouca atenção que o CO2 tem recebido na área redox”, afirmou Augusto.
Os resultados do trabalho, que contou com a colaboração dos pesquisadores uruguaios Rafael Radi e Natalia Rios, foram publicados na revista Chemical Research in Toxicology. “Considerei apropriado submeter a esse periódico porque nele publicamos nossos primeiros trabalhos sobre o envolvimento do peroximonocarbonato em processos biológicos quando o oxidante era ignorado na biologia”, disse a pesquisadora.
Método
Para detectar o peroximonocarbonato, os pesquisadores usaram medidas de fluorescência com sondas de boronato. Primeiro, eles geraram numa reação enzimática concentrações fisiológicas de peróxido de hidrogênio em estado estacionário, ou seja, em produção constante, e mediram a fluorescência de uma sonda de boronato na presença e na ausência de CO2. Os boronatos são usados para detectar oxidantes como peróxido de hidrogênio, peroxinitrito, ácido hipocloroso e peroximonocarbonato, que reagem com eles em velocidades e intensidades diferentes, permitindo a identificação desses oxidantes. Em 2018, Augusto e Truzzi demonstraram que o peroximonocarbonato oxida os boronatos com maior velocidade que o peróxido de hidrogênio.
O estudo em células foi feito com macrófagos ativados para gerar peróxido de hidrogênio. Macrófagos são células do sistema imune que, dependendo do tipo de ativação, geram diferentes oxidantes. Os pesquisadores fizeram vários controles para concluir que as células não estavam gerando nem peroxinitrito nem ácido hipocloroso, mas sim peroximonocarbonato quando em presença de CO2.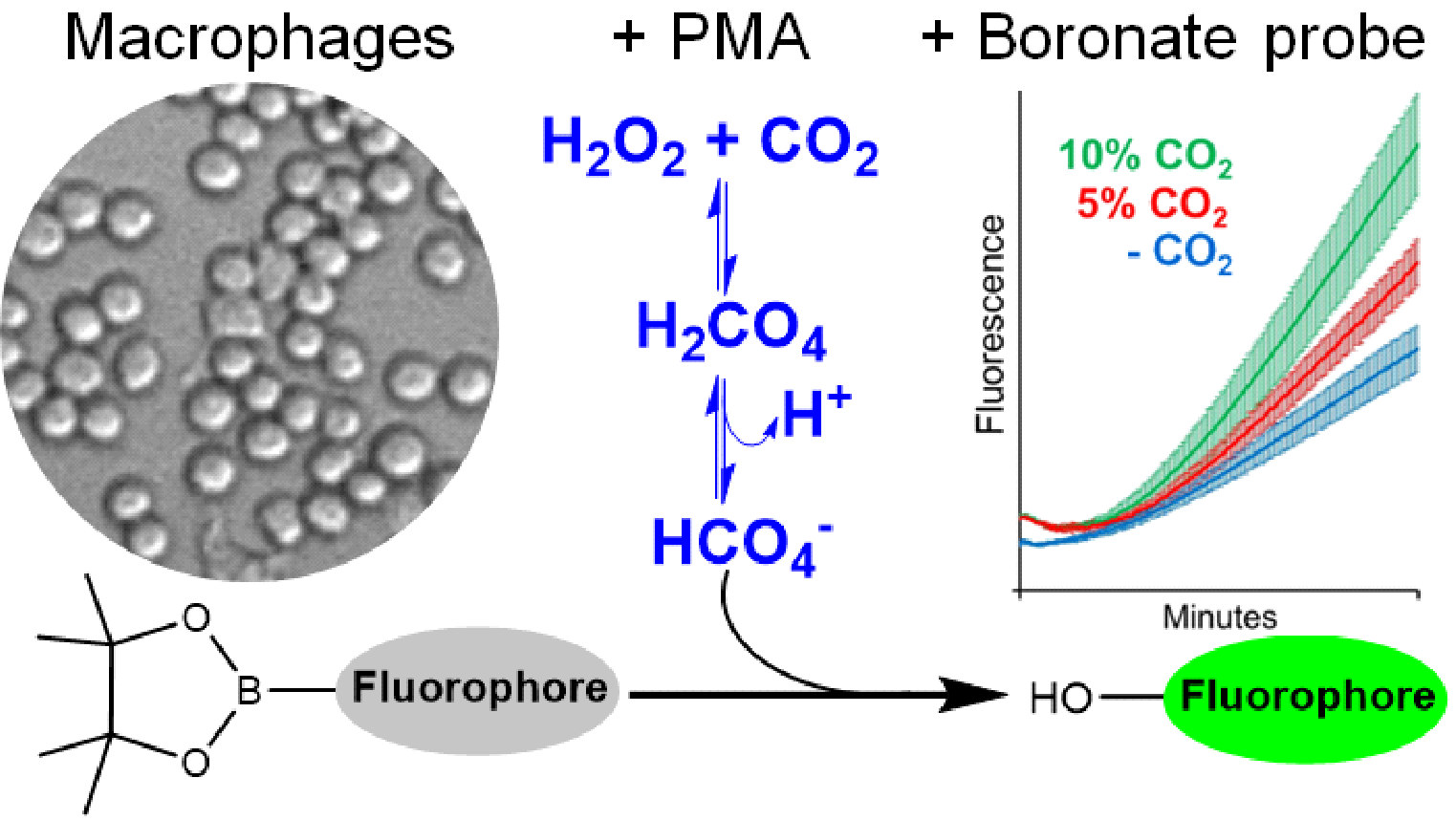
“Esse é um método relativamente simples para detectar o peroximonocarbonato em concentrações fisiológicas de peróxido de hidrogênio e CO2. Antes isso era impossível, mas hoje pesquisadores podem considerar que alguns efeitos que eles observem em células, como maior oxidação de determinadas proteínas ou respostas celulares, podem ser devido ao peroximonocarbonato e eles vão poder testar isso”, afirmou a pesquisadora.
Embora seja um oxidante conhecido dos químicos desde a década de 1960 e tenha aplicações tecnológicas como desinfetante e branqueador, não se considerava que o peroximonocarbonato pudesse ser formado em células, devido às baixas concentrações de seus precursores e à sua velocidade de formação. Augusto conta que só a partir dos anos 2000 o oxidante começou a ser investigados em sistemas biológicos, sendo que, inicialmente, o foco era no dano oxidativo.
Em 2006, Augusto e seu grupo publicaram no Chemical Research in Toxicology (CRT) um artigo mostrando que o peroximonocarbonato acelerava a oxidação da glutationa e albumina mediada por peróxido de hidrogênio e sugeriram que poderia ser um oxidante biológico. Além disso, esses resultados se somaram a dados emergentes de que o principal tampão fisiológico, o tampão CO2/bicarbonato, seria redox ativo.
Em 2019, a pesquisadora neozelandesa Christine Winterbourn e colaboradores mostraram em células que a sinalização mediada pelo fator de crescimento EGF (epidermal growth fator) dependia da presença de CO2 e propuseram que seria mediada por peroximonocarbonato. No mesmo ano, os grupos de Augusto e de Winterbourn, independentemente, demonstraram que o peroximonocarbonato promovia a superoxidação de peroxiredoxinas 2 Cys, enzimas também envolvidas em sinalização redox.
A partir daí, a pesquisa sobre o peroximonocarbonato e sobre os efeitos do CO2 nos organismos aeróbicos tem atraído mais atenção na literatura.
Sinalização redox e CO2
A sinalização redox é uma resposta adaptativa. “Há vários níveis de estresse. Quando há um ligeiro aumento de estresse, a célula se adapta. A formação de oxidantes pode, por exemplo, fazer com que genes de enzimas antioxidantes sejam expressos, para responder, no caso, ao estresse oxidativo. E muitas vias que levam a respostas celulares envolvem tiól proteínas, as quais o peroximonocarbonato oxida mais rápido que o peróxido de hidrogênio”, explica Augusto, acrescentando que o dano celular irreversível só ocorre quando a formação de oxidantes é muito grande.
O CO2 é um dos precursores do peroximonocarbonato junto com o peróxido de hidrogênio. O gás está naturalmente presente na atmosfera e é um constituinte normal do corpo humano, que exala cerca de 1,0 kg de CO2 por dia como produto do metabolismo.
Do ponto de vista redox, o CO2 modula a reatividade tanto do peróxido de hidrogênio quanto do peroxinitrito, dois importantes metabólitos do oxigênio molecular. Além disso, ele altera expressão de genes, inclusive daqueles envolvidos em inflamação, e está envolvido na nitração de proteínas via peroxinitrito, e na cabamilação de proteínas, outra modificação pós-tradução que pode alterar a função biológica das proteínas. Embora sejam necessárias mais evidências de seu papel como oxidante biológico, o peroximonocarbonato aparece como um dos possíveis intermediários dos efeitos danosos de níveis aumentados de CO2 em nosso organismo. A pesquisadora destaca que o CO2 também age por mecanismos não redox.
Em um artigo de revisão publicado na revista Nature Sustainability em 2019, pesquisadores americanos alertaram para os riscos potenciais à saúde da exposição a níveis elevados de CO2 em ambientes fechados, incluindo inflamação, reduções nas habilidades cognitivas de nível superior, desmineralização óssea, calcificação renal, estresse oxidativo e disfunção endotelial. Segundo os autores, tradicionalmente se considerava que os níveis de CO2 precisariam atingir uma concentração de pelo menos 5.000 partes por milhão (ppm) antes de afetarem a saúde humana. No entanto, pesquisas sugerem que níveis de CO2 tão baixos quanto 1.000 ppm podem causar problemas de saúde, mesmo que a exposição dure apenas algumas horas.
O artigo Production of Peroxymonocarbonate by Steady-State Micromolar H2O2 and Activated Macrophages in the Presence of CO2/HCO3− Evidenced by Boronate Probes, de Edlaine Linares, Divinomar Severino, Daniela R. Truzzi, Natalia Rios, Rafael Radi e Ohara Augusto pode ser lido aqui.
