Novo mecanismo de importação e maturação do principal antioxidante das mitocôndrias humanas é revelado
O metabolismo energético mitocondrial é a principal fonte do radical superóxido e de água oxigenada (H2O2) na maioria das células eucariontes. Em condições fisiológicas, o H2O2 é continuamente gerado, de maneira regulada, participando de processos como diferenciação celular e envelhecimento. Contudo, em concentrações elevadas, pode induzir danos a proteínas, membranas e DNA mitocondrial, prejudicando a produção de ATP e comprometendo funções metabólicas vitais. Desta forma, o H2O2 desempenha um papel dual na sinalização celular e no dano oxidativo.
Para compreender as funções do H2O2, é importante saber em quais compartimentos da mitocôndria esse oxidante é gerado e onde ele é degradado. A peroxirredoxina 3 (Prdx3) é a principal enzima responsável pela remoção do H2O2. Ela é sintetizada no citoplasma pelos ribossomos e, em seguida, transportada para as mitocôndrias. No entanto, os mecanismos que regulam esse transporte eram, até então, desconhecidos.
Agora, pesquisadores do CEPID Redoxoma elucidaram os mecanismos moleculares do transporte da Prdx3 do citosol para a mitocôndria. Além disso, revelaram que a Prdx3 está presente não apenas na matriz mitocondrial, como se acreditava anteriormente, mas também no espaço intermembranas.
As mitocôndrias possuem duas membranas, interna e externa, que organizam funcional e espacialmente a organela. O espaço entre as duas membranas delimita o chamado espaço intermembranas, enquanto a matriz mitocondrial é delimitada pela membrana interna.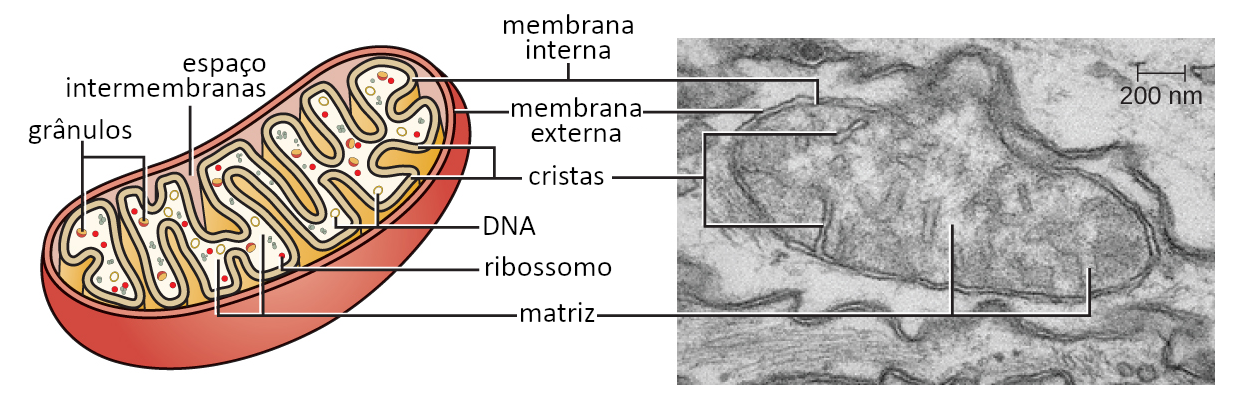
“Demonstramos que a Prdx3 está localizada em dois compartimentos mitocondriais e esse conhecimento abre novas perspectivas no estudo das funções dessa enzima, com impactos para o entendimento da sinalização celular mediada por H2O2 mitocondrial,” disse Fernando Gomes, principal autor do estudo publicado na revista Redox Biology. Gomes é pós-doutorando no Laboratório de Proteínas e Biologia Redox no Instituto de Biociências da USP, sob supervisão do professor Luis E.S. Netto, do CEPID Redoxoma.
Segundo os pesquisadores, a dupla localização da Prdx3 levanta questões interessantes sobre seus papéis específicos em cada compartimento. “Na matriz, vejo mais o papel de antioxidante mesmo, porque tem muito H2O2 sendo gerado. No espaço intermembranas, acredito que a Prdx3 possa ter um efeito sinalizador ou mesmo participar da formação de dissulfeto em proteínas-alvo, embora a gente ainda não tenha evidências disso,” explicou Netto.
Outro ponto importante é que o espaço intermembranas atua como uma barreira, impedindo a difusão do H2O2 mitocondrial para o citosol. A Prdx3 presente neste compartimento provavelmente desempenha um papel-chave no controle dessa difusão.
Netto destaca que o volume do espaço intermembranas é muito menor do que o da matriz e, em geral, bem menos estudado. “Talvez a descoberta de que a Prdx3 está também no espaço intermembranas ajude a revelar outros processos que acontecem nesse compartimento mitocondrial.”
Mecanismo
Os pesquisadores determinaram a dupla localização da Prdx3 e investigaram os mecanismos de importação da enzima usando mitocôndrias altamente purificadas de células HEK293T.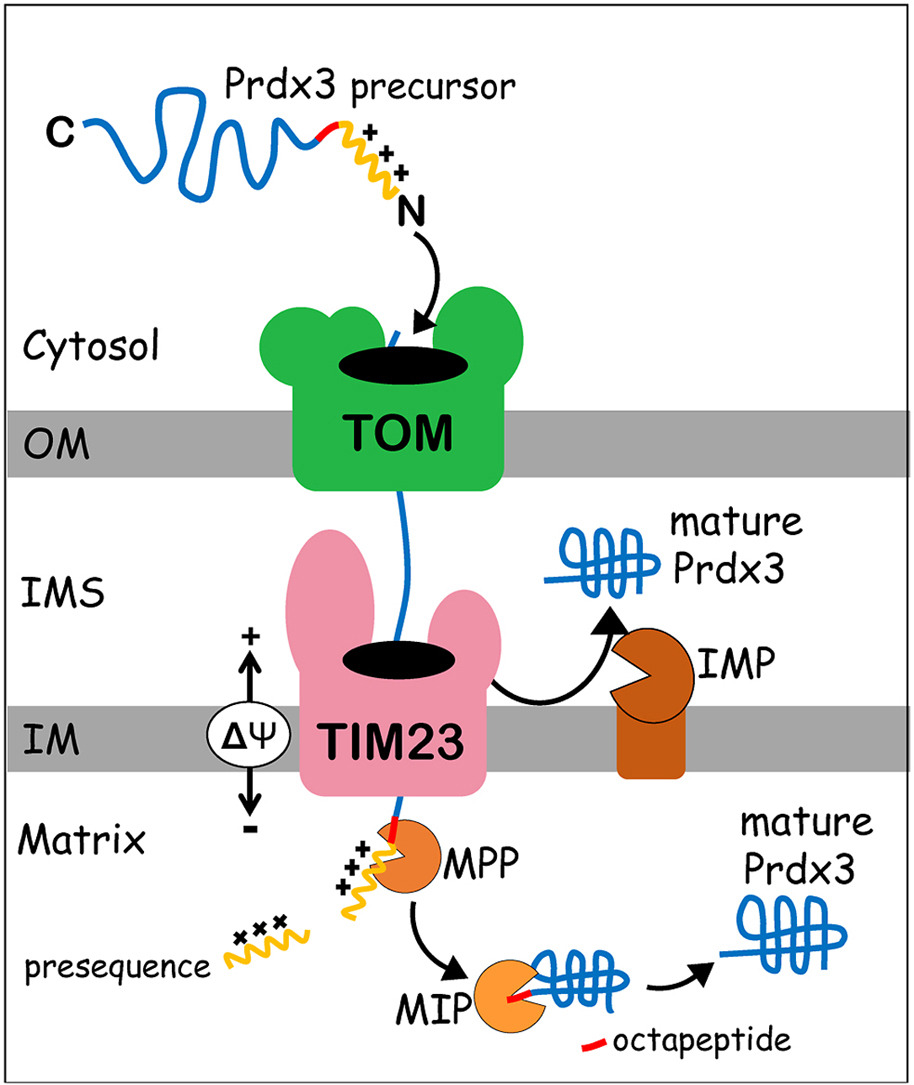
A maioria das proteínas mitocondriais (99%) é codificada por genes nucleares, traduzida no citoplasma e posteriormente importada para o interior da organela por complexos proteicos transportadores localizados nas membranas externa e interna. Uma parcela significativa dessas proteínas é sintetizada com uma sequência específica de aminoácidos localizada na região N-terminal, chamada de pressequência, que funciona como um sinal de direcionamento para a matriz mitocondrial. Após a importação, a maioria das pressequências é removida pela ação da peptidase de processamento mitocondrial (MPP), resultando em proteínas mitocondriais maduras. No entanto, um subconjunto de proteínas passa por etapas de processamento adicionais, como por exemplo pela ação da peptidase intermediária mitocondrial (MIP).
A importação da Prdx3 para a matriz mitocondrial segue esse processo. “A proteína direcionada para a matriz é primeiro clivada pela protease MPP, que retira a pressequência. Depois dessa primeira clivagem, a MIP realiza uma segunda clivagem para remover oito aminoácidos adicionais. Há muito tempo nos perguntamos qual a razão dessa segunda clivagem, já que a primeira remove grande parte do sinal. Acreditamos que a retirada desses oito aminoácidos seja importante para deixar a Prdx3 mais estável na organela,” disse Gomes.
A partir de dados de proteômica mitocondrial publicados anteriormente, os pesquisadores criaram uma lista abrangente de proteínas humanas, de camundongo e de rato contendo o motivo R-10, que faz parte da pressequência das proteínas clivadas tanto pela MPP quanto pela MIP. Por meio dessas análises, eles determinaram pela primeira vez um local de consenso para a clivagem sequencial por essas proteases. Também mostraram que todos os componentes do sistema antioxidante mitocondrial tiorredoxina/peroxirredoxina de mamíferos possuem o motivo R-10, indicando que muito provavelmente eles também passem por processamento sequencial por MPP e MIP durante sua maturação.
Ao expressar a Prdx3 humana em linhagens de levedura selvagem e mutante nulo para uma outra protease mitocondrial, os pesquisadores mostraram que o direcionamento da proteína para o espaço intermembranas depende do complexo peptidase da membrana interna (IMP). No entanto, como Netto observa, ainda há questões não resolvidas. “A mesma sequência de aminoácidos direciona a proteína para dois locais diferentes. Compreender isso ainda é um desafio para nós.”
Perspectivas
A Prdx3 tem um ciclo catalítico complexo. Curiosamente, quando há excesso de peróxido de hidrogênio, a enzima pode ser superoxidada, perdendo a capacidade de remover o peróxido de hidrogênio, que pode, então, atuar na sinalização redox. Além disso, “quando ela está reduzida, forma um oligômero de 12 unidades; quando oxidada, tem a forma de um dímero. É até curioso do ponto de vista bioquímico, pois ela transita de um dímero para um dodecâmero”, comenta Netto.
Para explorar a importância fisiológica da dupla localização da Prdx3 nas mitocôndrias, Gomes criou uma linhagem celular na qual deletou o gene que codifica a enzima, utilizando a tecnologia CRISPR-Cas9. Agora, ele planeja adicionar um plasmídeo expressando a proteína direcionada exclusivamente para a matriz ou para o espaço intermembranas, para analisar a dinâmica da difusão do H2O2 .
Pesquisas recentes têm mostrado a relevância mais ampla da Prdx3 em processos tanto fisiológicos quanto patológicos. “Em um destes estudos foi mostrado o envolvimento da Prdx3 superoxidada na sinalização da ferroptose, que é um tipo de morte celular não programada. Outro estudo mostrou a importância da Prdx3 na manutenção e auto-renovação de células tronco cancerígenas, especificamente em glioblastoma, um tipo de tumor cerebral. Estudar o papel da dupla localização mitocondrial da Prdx3 nesses processos será fundamental,” observou Gomes.
O artigo Human mitochondrial peroxiredoxin Prdx3 is dually localized in the intermembrane space and matrix subcompartments, de Fernando Gomes, Helena Turano, Luciana A. Haddad e Luis.E.S. Netto pode ser lido aqui.
