Estudo mostra papel de proteína redox na hipertensão arterial
A hipertensão arterial, doença que afeta mais de 30% da população adulta mundial, está associada à disfunção endotelial, que se caracteriza pelo desequilíbrio na liberação de fatores contráteis e relaxantes, com aumento da produção de espécies reativas de oxigênio em detrimento do óxido nítrico. A principal fonte do radical livre superóxido em células vasculares é a enzima NADPH oxidase 1 (Nox1), cuja ativação pode ser regulada por diversos fatores, dentre os quais a proteína dissulfeto isomerase A1 (PDIA1).
Em artigo publicado no Journal of Hypertension, pesquisadores do CEPID Redoxoma liderados pela professora Lucia Rossetti Lopes, do Instituto de Ciências Biomédicas (ICB) da USP, mostraram que a PDIA1 exerce um papel importante na patogênese da hipertensão por meio da regulação da expressão do gene Nox1 induzida pelo fator de transcrição ATF1 e pela mobilização de cálcio, o que aumenta o tônus vascular e contribui para a elevação da pressão arterial. Anteriormente, os autores já haviam identificado a PDI como uma nova proteína que regula a sinalização da Nox1 em células musculares lisas vasculares (CMLVs).
“Mostramos agora como a regulação da PDI acontece em nível transcricional: ela atua no gene da Nox1, regulando a expressão genica da enzima. O bonito desse trabalho é que investigamos a sinalização nas células e depois testamos o efeito funcional no vaso, em artérias de ratos espontaneamente hipertensos. É um estudo completo.” afirmou Lucia Lopes.
A PDIA1, ou apenas PDI, é o protótipo da família das PDIs, que pertence à superfamília da tiorredoxina. É uma proteína ubíqua essencial para a sobrevivência de nossas células, com importantes funções fisiológicas. A PDI participa da sinalização e da homeostase redox. Sua função clássica é catalisar a inserção de pontes dissulfeto em proteínas nascentes no retículo endoplasmático (RE), garantindo seu enovelamento correto.
A relação entre a PDI e a produção de oxidantes passa pela NADPH oxidase (Nox), uma família de enzimas que catalisa a redução do oxigênio molecular gerando o ânion radical superóxido, que, por sua vez, participa da geração de outros oxidantes. Na vasculatura humana, vários membros da família Nox controlam funções fisiológicas, como crescimento, migração e modificações na matriz extracelular em células musculares lisas vasculares (CMLVs). As Noxs também estão envolvidas na regulação do tônus vascular. Elas estão distribuídas por toda a parede do vaso e particularmente a Nox1 está envolvida na migração das CMLVs da camada medial para a íntima, o que contribui para a formação de neoíntima, estenose vascular e aumento da pressão arterial.
Resultados
Comparando células musculares lisas vasculares (CMLVs) de ratos espontaneamente hipertensos com células de ratos Wistar controles, os pesquisadores constataram que a PDI aumenta a transcrição de Nox1, por meio da ativação do receptor do fator de crescimento epidérmico (EGFR), responsável pela sinalização, proliferação, migração e contração celular. A PDI também promove o transporte do fator de transcrição ATF1 para o núcleo das células. Ao investigar a região do gene da Nox1 com a qual o ATF1 se associa, descobriram que ele se liga aos intensificadores (enhancers), que são sequências que aumentam a expressão genica.
“O aumento da atividade da Nox1, ou seja, o aumento da produção de superóxido, ativa a metaloprotease que cliva o ligante Hb-EGF. Este, por sua vez, ativa o receptor EGRF, que ativa o fator de transcrição ATF1 via sinalização da ERK 1/2. O ATF1, então, migra para o núcleo, onde aumenta a expressão da Nox1, que vai para a membrana,” explicou Lopes.
Além disso, eles mostraram pela primeira vez que a sulfenilação da PDI por peróxido de hidrogênio contribui para a ativação do EGFR na hipertensão. A sulfenilação da PDI foi maior em células de ratos espontaneamente hipertensos do que em animais controles, sugerindo maior oxidação de PDI na pressão alta.
O silenciamento ou a inibição farmacológica da PDI nas células musculares lisas vasculares diminuiu significativamente a ativação de EGFR e a transcrição de Nox1. Já a superexpressão da proteína aumentou a ativação de EGFR induzida por angiotensina II e a translocação de ATF1 para o núcleo.
Para investigar se a modulação da sinalização Nox1 pela PDI se traduzia em respostas funcionais, os pesquisadores avaliaram a resposta contrátil à angiotensina II em artérias de resistência periférica de ratos espontaneamente hipertensos. Eles concluíram que a PDI aumenta a mobilização intracelular de cálcio e as respostas de ANG II nessas artérias. “Diferente da maioria dos trabalhos que usa células da aorta, que são vasos de condutância, usamos células de artérias mesentéricas desses animais. Essas artérias têm um calibre muito menor, portanto são vasos de resistência,” disse a pesquisadora.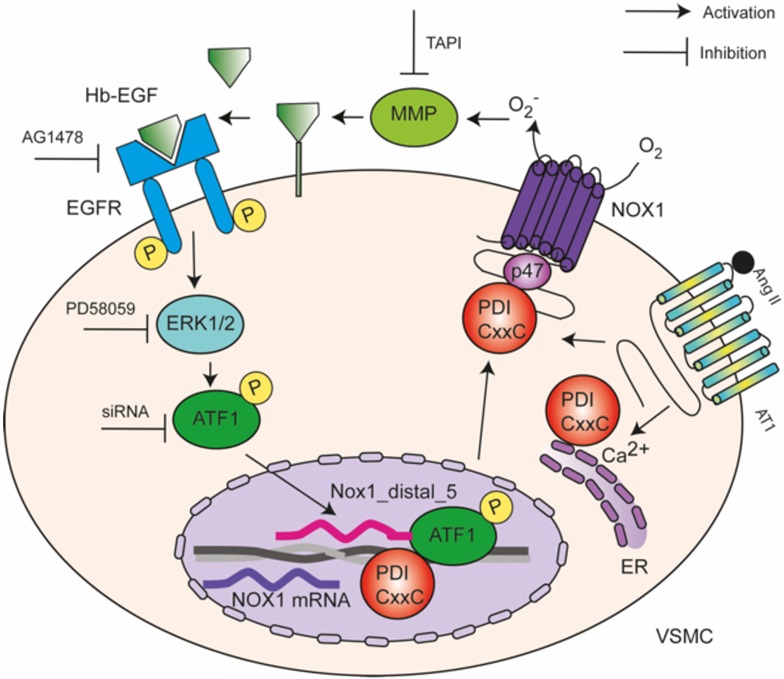
Alvo Terapêutico
A hipertensão arterial, chamada de “doença silenciosa” por não apresentar sintomas óbvios, é um fator de risco para acidente vascular cerebral, aneurisma, infarto do miocárdio e doença renal crônica. “No envelhecimento, acontece o enrijecimento das artérias, que respondem menos a essa dilatação/contração, tornando-se menos elásticas. Isso é uma das características que vai fazer com que a doença apareça mais na população idosa,” disse Lopes.
No artigo, os pesquisadores mostram a correlação clara entre o aumento da expressão de Nox 1, da PDI e da pressão arterial. “É por isso que acho que tem algum potencial terapêutico. Atualmente, os principais medicamentos que a gente utiliza para tratar a hipertensão arterial são os inibidores da ECA, que inibem a formação de angiotensina II, um dos principais ativadores da Nox 1. Os inibidores da ECA indicam que ~o mecanismo que revelamos pode realmente ser um alvo terapêutico.“
A grande questão, segundo a pesquisadora, seria descobrir uma nova classe de fármacos com maior especificidade, e, portanto, menos efeitos colaterais. “Teríamos que procurar inibidores que pudessem inibir a via da angiotensina II downstream do receptor AT1, que fossem mais específicos. A PDI poderia oferecer um caminho para isso”.
O artigo Protein disulfide isomerase-mediated transcriptional upregulation of Nox1 contributes to vascular dysfunction in hypertension, de Livia De Lucca Camargo, Silvia Cellone Trevelin, Guilherme Henrique Gatti da Silva, Ana Alice dos Santos Dias, Maria Aparecida Oliveira, Olga Mikhaylichenko, Aline C.D. Androwiki, Celio Xavier dos Santos, Lisa-Marie Holbrook, Graziela Scalianti Ceravolo, Alexandre Denadai-Souza, Izabela Martina Ramos Ribeiro, Simone Sartoretto, Francisco Rafael Martins Laurindo, Patricia Pereira Coltrl, Vagner Roberto Antunes, Rhian Touyz, Francis J. Miller Jr., Ajay M. Shah, and Lucia Rossetti Lopes, pode ser lido aqui.
