Deficiência do proteassomo compromete função mitocondrial em levedura
Nas células eucarióticas, o proteassomo é um complexo proteico responsável por eliminar proteínas danificadas e não funcionais, ajudando a manter o equilíbrio e o bom funcionamento celular. Já as mitocôndrias são o centro do metabolismo energético e produzem a maior parte da energia necessária para o funcionamento celular.
Nos últimos anos, estudos vêm revelando que esses dois sistemas estão mais conectados do que se imaginava: o proteassomo participa do controle de qualidade de proteínas destinadas à mitocôndria, enquanto o metabolismo mitocondrial influencia a eficiência da degradação de proteínas marcadas para destruição.
Um novo estudo do CEPID Redoxoma, liderado por Marilene Demasi, do Instituto Butantan, apresenta um modelo experimental valioso para investigar a interação entre o proteassomo e a funcionalidade mitocondrial.
A pesquisa teve como foco os efeitos da disfunção do proteassomo na cepa mutante C76S da levedura Saccharomyces cerevisiae e revelou que a deficiência nesse sistema leva a um aumento do estresse oxidativo mitocondrial. Esse efeito foi evidenciado pela maior liberação de peróxido de hidrogênio (H2O2) e menor concentração da peroxirredoxina 1 (Prx1), uma enzima crucial na remoção de peróxidos. Nos mamíferos, a Prx3 mitocondrial é equivalente à Prx1 da levedura.
“O mais importante neste trabalho é termos uma linhagem de levedura que sirva como modelo para investigar o déficit de proteassomo na interlocução com o metabolismo mitocondrial. Esse modelo ainda não existia na literatura,” destaca Demasi.
O estudo, que contou com a colaboração dos grupos dos pesquisadores Mario H. Barros, do ICB-USP, e Luis E.S. Netto, do IB-USP, ambos integrantes do CEPID Redoxoma, foi publicado na revista Archives of Biochemistry and Biophysics.
Déficit redox
A pesquisa utilizou a cepa mutante C76S de Saccharomyces cerevisiae, previamente caracterizada pelo grupo de Demasi, na qual um resíduo de cisteína é substituído por serina na subunidade alfa-5 do proteassomo 20S. Em condições fermentativas, essas células apresentam vida útil cronológica reduzida, disfunção do proteassomo e acúmulo de proteínas poliubiquitinadas.
Para investigar o papel das mitocôndrias nesse modelo celular, os pesquisadores primeiro cultivaram a cepa mutante C76S em meio respiratório contendo glicerol e etanol como fontes de carbono, com o objetivo de estimular a proliferação mitocondrial.
Logo nos primeiros ensaios fenotípicos, eles notaram que a curva de crescimento da levedura nesse meio era deficitária e que as células apresentavam alterações morfológicas. Esses indícios motivaram uma investigação mais aprofundada do metabolismo dessas células.
“Quando fomos avaliar o papel do proteassomo, vimos logo de início um acúmulo de proteína poliubiquitinada, o que significa que o proteassomo não estava degradando as proteínas adequadamente, uma vez que que verificamos deficit da atividade catalítica do proteassomo 20S assim como de seu acoplamento à unidade regulatória 19S, responsável pelo reconhecimento de proteínas poliubiquitinadas,” explicou Demasi. “Posteriormente, analisamos o consumo de oxigênio por mitocôndrias isoladas e ficamos muito surpresos quando vimos que ele era muito elevado. Também a produção de ATP nessa linhagem era imensa, o que chamou muito a atenção”, acrescentou.
O sistema ubiquitina-proteassomo tem um papel central na regulação celular. Proteínas regulatórias são marcadas com ubiquitina, sinal que permite seu reconhecimento e degradação pelo proteassomo, quando a unidade catalítica 20S está acoplada à unidade regulatória 19S. Proteínas oxidadas ou mal estruturadas, no entanto, podem ser eliminadas independentemente dessa marcação, por meio do proteassomo 20S livre.
Outra descoberta relevante foi o aumento da atividade de alguns complexos da cadeia respiratória, mesmo na ausência de mudanças em sua abundância. Diante disso, os pesquisadores decidiram investigar a condição redox das mitocôndrias e identificaram o aumento da liberação do peróxido de hidrogênio, acompanhado por uma redução nos níveis da Prx 1. Na célula como um todo, eles detectaram uma alteração no pool de glutationa, um dos principais tampões redox intracelulares.
“Além disso, vimos a fragmentação do DNA, que é um importante marcador de apoptose, e liberação do citocromo c no citoplasma. Nossa conclusão foi que o aumento do estresse oxidativo aliado à perda da atividade do proteassomo leva essas células à morte por apoptose,” explicou Demasi.
Para testar se a Prx1 tem um papel causal no fenótipo observado, a equipe superexpressou a enzima na cepa mutante. O experimento resultou na reversão parcial das alterações, demostrando de forma clara que a Prx1 é um fator fundamental na recuperação de células C76S.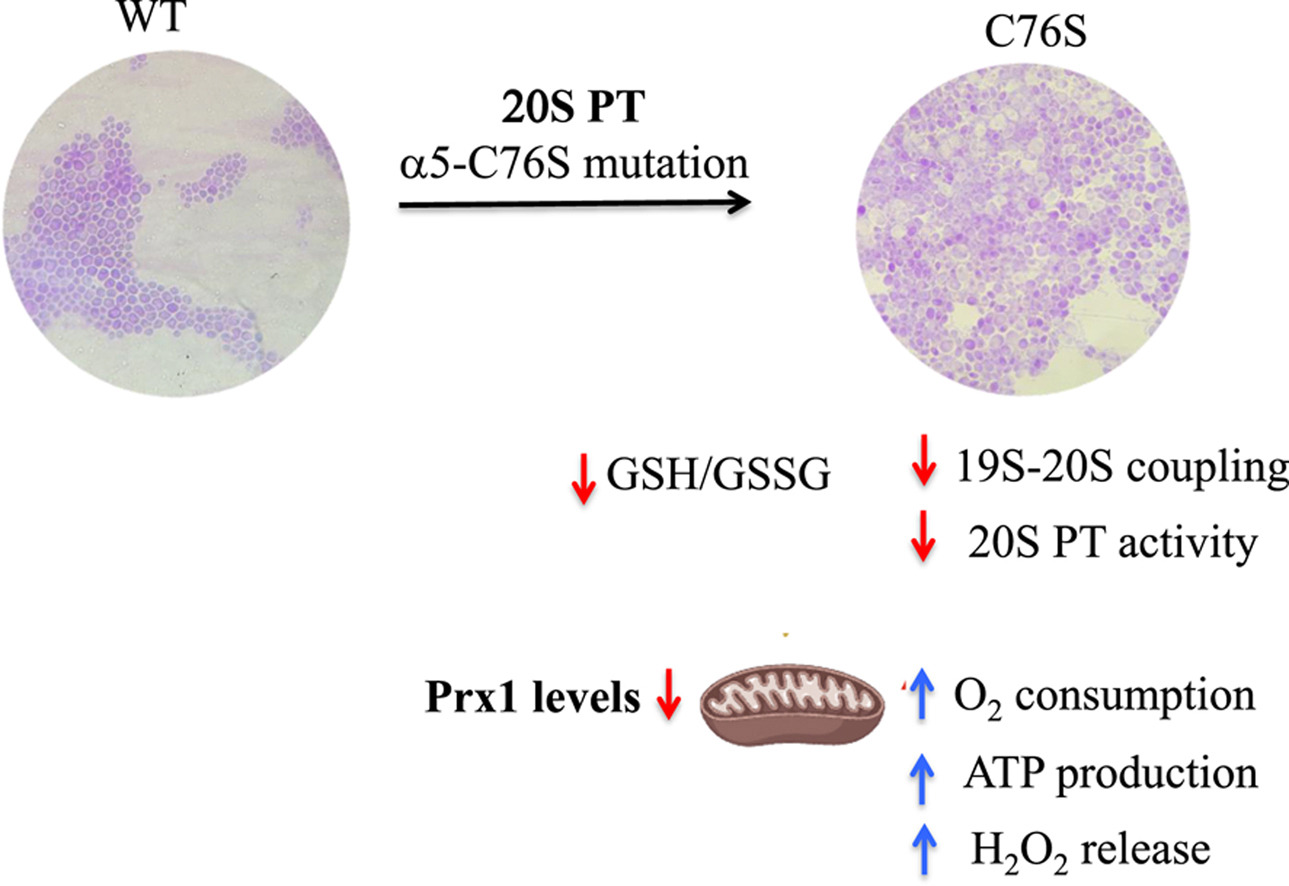
Próximos passos
Os pesquisadores estão agora trabalhando para entender por que os níveis de Prx1 estão diminuídos nas células com proteassomo comprometido. “Ainda não sabemos se houve uma diminuição na expressão gênica da Prx1, que é possível, já que o proteassomo também tem um papel na regulação em nível de transcrição gênica, ou se a proteína se oxida mais. Ela pode se hiperoxidar e, com isso, ser mais degradada. Talvez o excesso de peróxido esteja promovendo sua degradação contínua,” avalia a pesquisadora.
Para responder a essas questões, o grupo pretende realizar análises comparativas de transcriptoma e proteômica entre a linhagem selvagem e a mutante cultivadas em condição respiratória, com o objetivo de estabelecer essa linhagem como modelo para investigação do papel do sistema ubiquitina-proteassomo (UPS) no metabolismo celular.
O artigo Decreased levels of Prx1 are associated with proteasome impairment and mitochondrial dysfunction in the yeast Saccharomyces cerevisiae, de Natália Mori Avellaneda Penatti, Mário Henrique Barros, Fernando Gomes, Luis Eduardo Soares Netto, Kamila de Jesus Maciel, Vincent Louis Viala, Ana Mara Viana e Marilene Demasi, pode ser lido aqui.
