Como a hiperglicemia aumenta o risco de trombose
Uma pesquisa de cientistas do CEPID Redoxoma revelou novos mecanismos pelos quais a hiperglicemia provoca a trombose. O estudo pode levar a estratégias direcionadas para prevenir disfunção cardiovascular em pessoas com diabetes ou naquelas que apresentam hiperglicemia prolongada. Os resultados foram publicados no Journal of Thrombosis and Haemostasis.
“A principal causa de morte na população brasileira e em vários outros países latino-americanos são eventos isquêmicos, doenças cardiovasculares, como infarto e AVC isquêmico, nos quais a trombose arterial é o evento causal precipitante. Essas doenças podem ser precipitadas por uma série de fatores de risco, como hiperglicemia, dislipidemia,e hipertensão. Desses fatores, a hiperglicemia parece se associar de maneira muito importante com as doenças cardiovasculares. Então, a relevância do problema que a gente aborda parte daí,” afirmou Renato S. Gaspar, que realizou a pesquisa durante o pós-doutorado, sob a supervisão de Francisco Rafael Martins Laurindo, do Instituto do Coração da Faculdade de Medicina da USP e do CEPID Redoxoma. Atualmente, Gaspar é docente do Departamento de Medicina Translacional da Unicamp.
A hiperglicemia ocorre quando há um excesso de glicose no sangue e é uma das manifestações do diabetes. Em um estudo publicado em 2022 na revista PLOS ONE, os pesquisadores mostraram que, no Brasil, entre 2005 e 2017, a hiperglicemia foi o fator de risco que mais se associou a mortes por doenças cardiovasculares em comparação com outros fatores modificáveis.
Condições de hiperglicemia prolongada, como a cetoacidose diabética, estão associadas ao aumento do risco de trombose, ao provocar disfunção endotelial, que promove adesão plaquetária e a formação de trombos, ou coágulos sanguíneos. O endotélio é o revestimento interno dos vasos sanguíneos e plaquetas são células produzidas pela medula óssea que circulam na corrente sanguínea e ajudam o sangue a coagular.
Agora, os pesquisadores mostraram que, na hiperglicemia, a proteína dissulfeto isomerase A1 peri/epicelular (pecPDI) endotelial regula a interação entre as plaquetas e o endotélio, por meio de proteínas relacionadas à adesão e de alterações na biofísica da membrana endotelial.
“Mostramos uma via da PDI na célula endotelial que é mediadora da trombose no diabetes em condições de hiperglicemia, envolvendo um mecanismo molecular específico, que foi identificado,” afirmou Francisco Laurindo.
A PDI é uma enzima do retículo endoplasmático que tem a função clássica de catalisar a inserção de pontes dissulfeto em proteínas nascentes, para que elas se enovelem na forma correta. Também é encontrada no meio extracelular, como um pool secretado ou ligado à superfície celular, a pecPDI, em vários tipos de células, incluindo plaquetas e células endoteliais. Estudos vêm demonstrando que a pecPDI regula a trombose em vários modelos.
Modificações bioquímicas e biofísicas
Para investigar a relação das plaquetas com o endotélio na hiperglicemia, os pesquisadores criaram um modelo com células endoteliais da veia umbilical humana (HUVECs) cultivadas em diferentes concentrações de glicose. Produziram assim células normoglicêmicas, com níveis normais de glicose, e hiperglicêmicas, com excesso de glicose. A contribuição da proteína dissulfeto isomerase A1 (PDI) foi avaliada usando inibidores de PDI de célula inteira ou de pecPDI.
Inicialmente, as células foram incubadas com plaquetas coletadas de pessoas saudáveis. Nas células hiperglicêmicas, as plaquetas aderiram quase três vezes mais do que nas normoglicêmicas. Como a inibição da PDI anulou esse efeito, os pesquisadores concluíram que o processo é regulado pela pec-PDI do endotélio.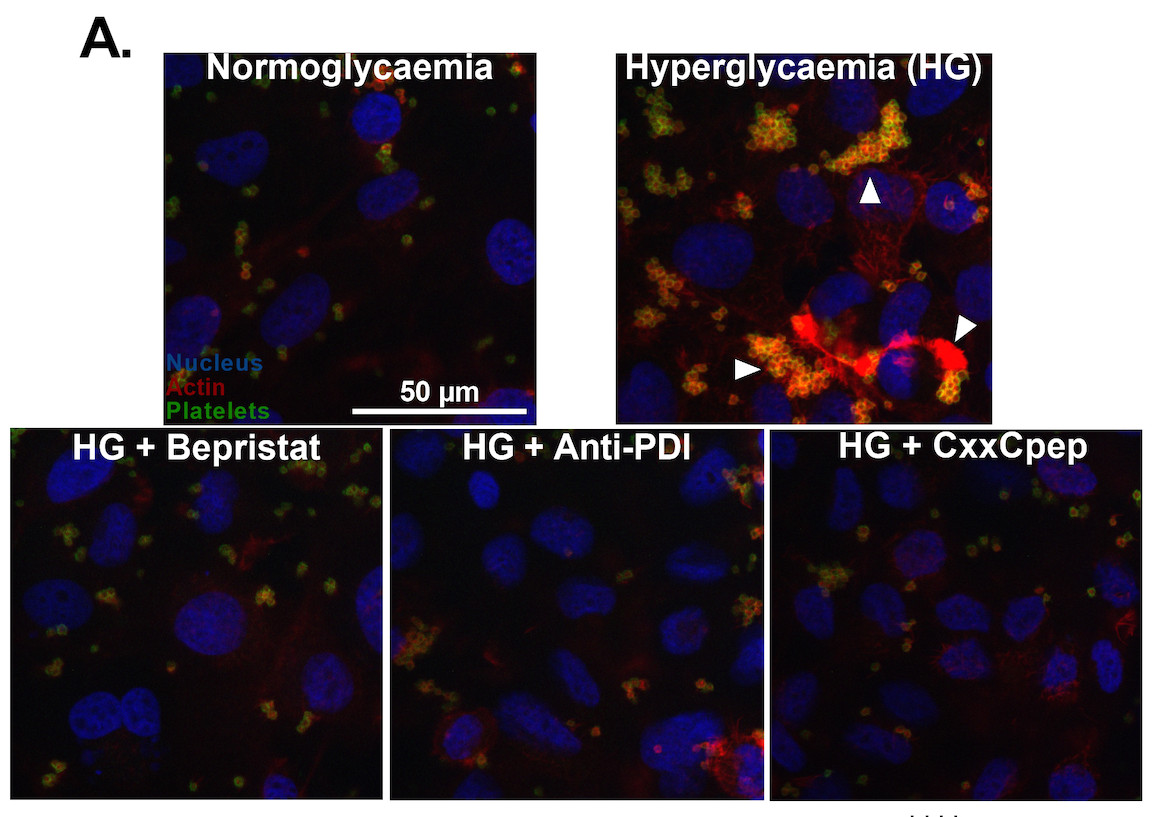
Para entender melhor o resultado, eles investigaram processos biofísicos, como o remodelamento do citoesqueleto das células endoteliais, e viram que as células hiperglicêmicas tinham fibras de filamento de actina mais bem estruturadas do que as células não hiperglicêmicas. Também mediram a produção de peróxido de hidrogênio, pois espécies reativas de oxigênio são mediadores da reorganização do citoesqueleto e da adesão celular. Neste caso, as células hiperglicêmicas geraram duas vezes mais peróxido de hidrogênio do que as normoglicêmicas.
A etapa seguinte foi investigar se a reorganização do citoesqueleto afetava a rigidez das membranas celulares, pois plaquetas tendem a aderir às superfícies mais rígidas. Com o uso de microscopia de força atômica, comprovaram que as células hiperglicêmicas eram mais rígidas que as normoglicêmicas. Os estudos de microscopia de força atômica foram realizados em colaboração com o grupo da pesquisadora Luciana Magalhães Rebelo Alencar, do Departamento de Física da Universidade Federal do Maranhão.
Para Gaspar, foi importante no trabalho abordar aspectos bioquímicos e biofísicos. “Eu acho que a gente quase nunca pensa na Biofísica, por exemplo na rigidez de proteínas. Mostrar que a PDI de alguma forma regula essa rigidez na célula endotelial talvez abra uma forma de pensar um pouco além da Bioquímica”.
As imagens obtidas por microscopia também mostraram a formação de prolongamentos das células, com vesículas extracelulares que pareciam se separar dos prolongamentos. Essa observação levou os pesquisadores a investigar o conjunto de proteínas secretadas pelas células, o secretoma, para saber se estavam liberando proteínas que pudessem aumentar a adesão plaquetária. “A ideia desse experimento era detectar proteínas que estariam exclusivamente expressas ou presentes em células hiperglicêmicas, e não nos controles ou naquelas tratadas com os inibidores da PDI”, explicou Gaspar. Para isso, realizaram estudos de proteômica, em colaboração com o grupo da pesquisadora Graziella Eliza Ronsein, do Instituto de Química da USP e do CEPID Redoxoma.
No secretoma, encontraram 947 proteínas, das quais selecionaram oito com papel na adesão celular. Eles então diminuíram a expressão gênica de três dessas proteínas usando a ferramenta de RNA de interferência e chegaram a duas proteínas, a SLC3A2 e a LAMC1, como moduladoras da adesão plaquetária. A SLC3A2 é uma proteína ligada à membrana e LAMC1 é a subunidade gama da laminina, um componente-chave da matriz extracelular.
A conclusão foi que a exposição à hiperglicemia induziu a secreção de proteínas específicas relacionadas à adesão e que a inibição da PDI e da pecPDI impediu que as células endoteliais secretassem essas proteínas.
Aplicação
A PDI é uma proteína envolvida na formação de trombos. Em estudos anteriores independentes, tanto Gaspar quanto Laurindo mostraram a relação da PDI com a NADPH oxidase 1 (Nox 1) em diferentes situações, inclusive na adesão plaquetária. As Noxs são enzimas que catalisam a redução do oxigênio molecular gerando o ânion radical superóxido, que, por sua vez, participa da geração de outros oxidantes.
Segundo os pesquisadores, já existem ensaios clínicos com inibidores da pec-PDI, com foco em doenças como anemia falciforme e trombose associada ao câncer. “Nosso trabalho adiciona a perspectiva de tratamento de uma nova doença, o diabetes. Talvez a gente possa olhar para a prevenção secundária de isquemia no diabetes,” afirmou Gaspar.
Para Laurindo, a perspectiva de que possam existir inibidores específicos da trombose no diabetes inclui não apenas a PDI, mas também as proteínas SLC3A2 e LAMC1. “Inibir a laminina é um pouco mais complicado, porque ela é uma proteína que tem várias funções, mas a SLC3A2 seria um alvo potencial e não tem nada na literatura sobre a inibição dessa proteína como um antitrombótico”.
O artigo Endothelial protein disulfide isomerase A1 enhances membrane stiffness and platelet-endothelium interaction in hyperglycemia via SLC3A2 and LAMC1, de Renato S. Gaspar, Álefe Roger Silva França, Percillia Victoria Santos Oliveira, Joel Félix Silva Diniz-Filho, Livia Teixeira, Iuri Cordeiro Valadão, Victor Debbas, Clenilton Costa dos Santos, Mariana Pereira Massafera, Silvina Odete Bustos, Luciana Magalhães Rebelo Alencar, Graziella Eliza Ronsein e Francisco R. M. Laurindo, pode ser lido aqui.
