Cientistas propõem atualização dos livros didáticos após estudo destacar o papel do sódio na transformação de energia mitocondrial
A transformação de formas de energia que nos mantêm vivos ocorre predominantemente nas mitocôndrias, o centro do metabolismo energético. A “moeda energética” do organismo, a adenosina trifosfato (ATP), é gerada nessas organelas por meio de um processo chamado fosforilação oxidativa. Estima-se que uma pessoa sintetize diariamente uma quantidade de ATP equivalente ao seu peso corporal.
A fosforilação oxidativa é um processo de transferência de energia impulsionado por gradientes elétricos e de prótons através da membrana interna mitocondrial. Esse mecanismo envolve o acoplamento da oxidação gradual de doadores de elétrons na cadeia de transporte de elétrons ao bombeamento de prótons através da membrana, gerando o gradiente eletroquímico necessário para a síntese de ATP. De certa forma, as mitocôndrias são semelhante a baterias.
Pesquisas recentes sobre a localização da cadeia de transporte de elétrons nas mitocôndrias e o papel do sódio na respiração mitocondrial levaram Alicia Kowaltowski, pesquisadora do Instituto de Química da USP e membro do CEPID Redoxoma, a defender a atualização dos livros didáticos. Em colaboração com Fernando Abdulkader, ela publicou um artigo intitulado Textbook Oxidative Phosphorylation Needs to Be Rewritten na revista Trends in Biochemical Sciences. O artigo destaca algumas grandes novas descobertas sobre mecanismos de fosforilação oxidativa, incluindo um estudo inovador publicado na revista Cell pelo pesquisador espanhol José Antonio Enríquez e sua equipe, que revelou o papel inesperado do sódio na manutenção do potencial de membrana mitocondrial.
“O conhecimento evolui, e o que apresentamos para os estudantes também deve evoluir”, explicou Kowaltowski. “Até alguns anos atrás, tínhamos certeza de que as mitocôndrias produziam ATP por fosforilação oxidativa no espaço onde a membrana interna interage com a membrana externa. Isso mudou, pois descobrimos que esse processo ocorre dentro das cristas mitocondriais. Os livros didáticos estão errados e está na hora de corrigir isso. Agora, com o trabalho do grupo do Enríquez, descobrimos que a propriedade do potencial de membrana também pode ser um pouco diferente, algo ainda não abordado nos livros didáticos”.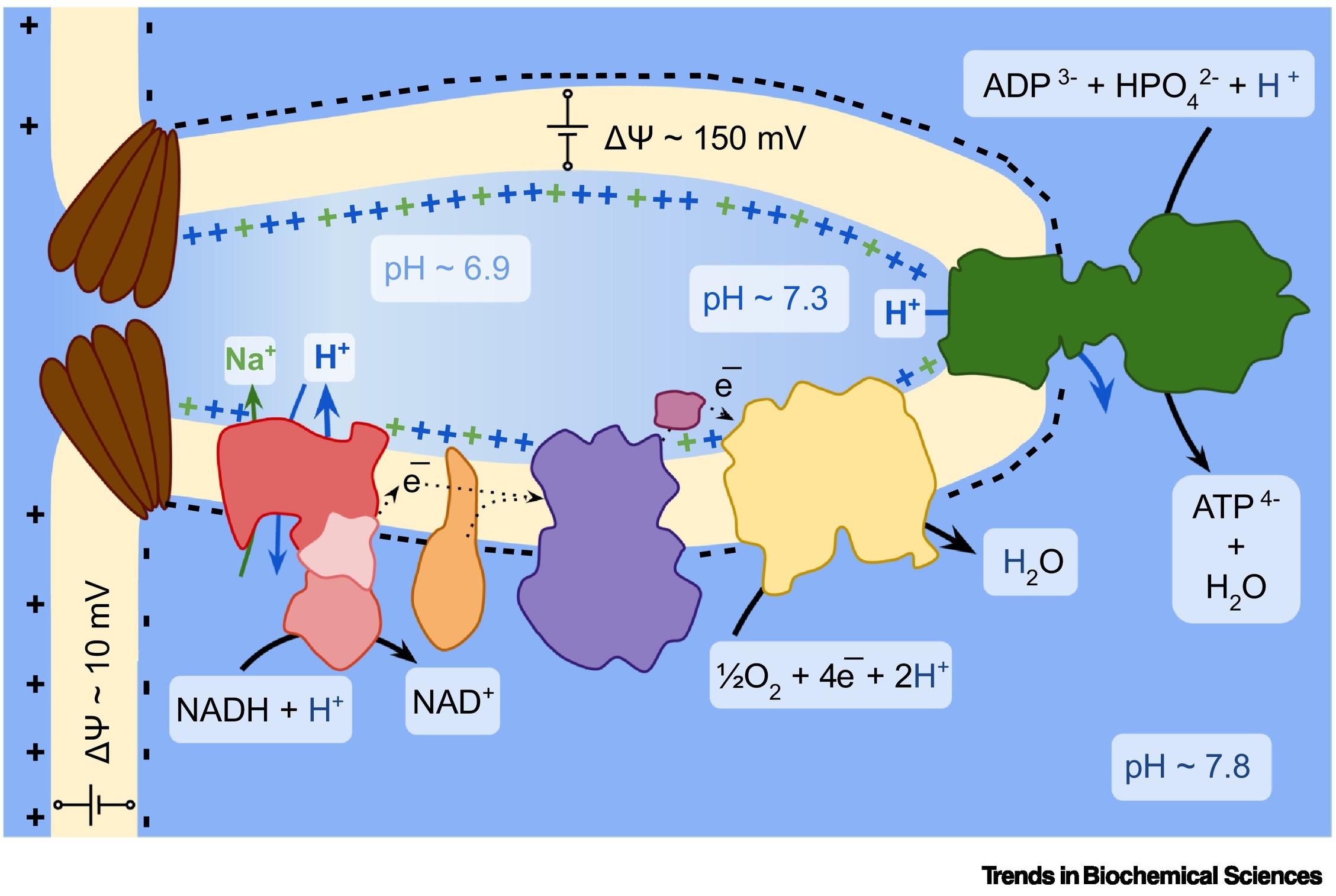
Sódio e potencial de membrana
Já se sabe há tempos que o gradiente de prótons (ΔpH) nas mitocôndrias é pequeno, devido aos mecanismos de tamponamento celular que estabilizam o pH. Por isso, o gradiente de carga (Δψ) tem sido considerado o componente dominante do bombeamento de prótons. Até recentemente, esse gradiente era atribuído ao potássio, o cátion mais abundante na célula.
No entanto, o estudo do grupo de Enríquez revelou que entre 30% e 50% desse gradiente pode ser atribuído ao sódio, transportado em troca de prótons dentro do complexo I da cadeia de transporte de elétrons.
O complexo I transfere elétrons, que vêm inicialmente da nossa comida, da coenzima NADH (nicotinamida adenina dinucleotídeo) para os outros complexos na cadeia. Uma parte desse complexo, no entanto, desempenha uma função adicional como trocador de íons de sódio por prótons.
“Esse estudo traz duas contribuições importantes: a identificação de uma segunda função fundamental do complexo I e a demonstração do papel do sódio na manutenção do potencial de membrana das mitocôndrias,” afirmou Enríquez em entrevista ao site do CEPID Redoxoma.
Como as mitocôndrias não possuem um transportador específico de sódio, a presença de um trocador de sódio por prótons no complexo I permite que a carga da membrana permaneça estável. E sempre que for necessário recuperar um gradiente de prótons, o mesmo complexo I pode transferir de volta o gradiente de sódio em gradiente de prótons. “Você pode pensar nisso como um estoque de energia, como as baterias de lítio ou de sódio,” disse Enríquez.
Ele ressaltou a relevância funcional dessa descoberta: “Fornecemos uma segunda função fundamental para uma proteína muito antiga e muito conhecida. Mas a consequência mais relevante é a funcionalidade. Porque uma coisa que todos nós consideramos, desde que Peter Mitchell desenvolveu a teoria quimiosmótica, é que o condutor do potencial de membrana na mitocôndria é na verdade a cadeia de transporte de elétrons que bombeia prótons contra o gradiente, estabelecendo uma diferença na concentração de prótons. Mas como os prótons são carregados, você estabelece duas coisas: uma concentração diferente de prótons, o que significa pH diferente, e uma carga diferente, porque é carregada positivamente. Então, em princípio, isso define o que chamamos de potencial de membrana. Mas, na verdade, a concentração de prótons através da membrana interna não justifica 100% a diferença no potencial de membrana.”
Segundo Kowaltowski e Abdulkader, embora a descoberta seja inesperada, devido à baixa concentração de sódio dentro das células, o artigo de Enríquez apresenta dados convincentes. Os pesquisadores utilizaram inúmeros modelos experimentais, incluindo mutantes de componentes da cadeia respiratória, além de diversas abordagens metodológicas, como o uso de diferentes ionóforos e meios depletados de sódio. Os experimentos envolveram medições bioenergéticas quantitativas cuidadosas, incluindo raras quantificações calibradas do potencial de membrana.
“Eles fizeram bioenergética quantitativa, que é uma coisa super rara na literatura. Há muitos estudos medindo o potencial de membrana, mas sem calibrar, sem ser quantitativo,” disse Kowaltowski. Recentemente, ela publicou o vídeo When and How to Measure Mitochondrial Inner Membrane Potentials (Quando e como medir os potenciais da membrana interna mitocondrial), além de um artigo de revisão sobre o assunto.
O estudo também revela que uma mutação pontual no complexo I associada à neuropatia óptica hereditária de Leber (LHON) dificulta especificamente a troca de sódio por prótons, sem afetar o transporte de elétrons ou o bombeamento de prótons pelo complexo. A neuropatia óptica hereditária de Leber é uma doença mitocondrial neurodegenerativa que afeta o nervo óptico, frequentemente causando perda de visão em jovens adultos.
Para Kowaltowski, “os pesquisadores não apenas descrevem um novo mecanismo central para o metabolismo energético, mas também o relacionam diretamente a uma doença”.
O artigo Textbook oxidative phosphorylation needs to be rewritten, de Alicia J. Kowaltowski, Fernando Abdulkader pode ser lido aqui.
O artigo A transmitochondrial sodium gradient controls membrane potential in mammalian mitochondria pode ser lido aqui.
