Cientistas desvendam mecanismo de resistência bacteriana envolvendo vitamina C
Ao longo da evolução, microrganismos patógenos, como bactérias, vírus e fungos, desenvolveram estratégias de defesa sofisticadas para sobreviver e se multiplicar no ambiente hostil de seus hospedeiros. Esses mecanismos aumentam sua virulência e tornam o combate às infecções mais difícil. Uma das estratégias mais eficazes é a neutralização de oxidantes liberados pelas células de defesa para eliminar invasores.
Em um artigo recente publicado na revista Redox Biology, o grupo do pesquisador Luis E. S. Netto, do Instituto de Biociências da USP e do CEPID Redoxoma, descreve como a proteína LsfA, uma peroxirredoxina do tipo 1-Cys, protege a bactéria Pseudomonas aeruginosa contra o peróxido de hidrogênio produzido durante a resposta imunológica. A LsfA catalisa a eliminação de hidroperóxidos utilizando o ascorbato (vitamina C) como redutor, o que reforça a defesa antioxidante da bactéria.
“Uma grande contribuição do nosso trabalho é a determinação estrutural de uma proteína envolvida na virulência de uma bactéria de importância médica. Também demonstramos que o ascorbato pode atuar como redutor em um sistema celular, o que é algo bastante novo. Em termos técnicos, fomos os primeiros a usar a sonda HyPer7 em Pseudomonas”, afirmou Rogério L. Aleixo-Silva, primeiro autor do artigo. Ele realizou a pesquisa ao longo de seu mestrado e doutorado no Laboratório de Proteínas e Biologia Redox do IB-USP e atualmente é pós-doutorando na University of Massachusetts Chan Medical School, nos Estados Unidos.
Os dados estruturais inéditos obtidos neste estudo podem abrir novas oportunidades para o desenvolvimento de inibidores específicos da enzima bacteriana, impulsionando o avanço de novas estratégias terapêuticas.
“Esse é o primeiro trabalho com a caracterização bioquímica e estrutural de uma Prx6 de bactéria. Na literatura, entre os três grandes domínios da vida — Eubacteria, Archaea e Eukarya — já existem muitas estruturas resolvidas de Prx6, principalmente em arqueas e mamíferos, inclusive humanos. Mas esta é a primeira estrutura de uma Prx6 de bactéria. A E. coli, que é um modelo clássico de bactéria, não possui Prx6,” afirmou Luis Netto.
Sistema antioxidante
A Pseudomonas aeruginosa é uma bactéria oportunista que provoca infecções principalmente em pessoas com o sistema imunológico debilitado. Ela é responsável por diversos tipos de infecções hospitalares, incluindo pneumonias em pacientes com fibrose cística, infecções urinárias, infecções em queimaduras e feridas cirúrgicas, além de endocardite e septicemia. Sua resistência a antibióticos a torna um dos patógenos bacterianos prioritários para o desenvolvimento de novos tratamentos na lista da Organização Mundial da Saúde (OMS).
Quando infectado por um patógeno, o organismo reage mobilizando suas defesas imunológicas, como os fagócitos, células que combatem microrganismos liberando espécies reativas de oxigênio, nitrogênio e cloro. Diante desse estresse oxidativo, bactérias como a P. aeruginosa ativam mecanismos de proteção que envolvem diversas proteínas antioxidantes, entre elas as peroxirredoxinas (Prxs).
A LsfA é uma peroxirredoxina da subfamília Prx6 presente na P. aeruginosa e associada à virulência bacteriana. Estudos anteriores, conduzidos pela pesquisadora Regina Baldini, do Departamento de Bioquímica do IQ-USP, já haviam demonstrado sua importância em modelos de infecção com macrófagos e camundongos. No novo trabalho, os pesquisadores aprofundaram a compreensão dos mecanismos moleculares envolvidos em sua função protetora, mostrando que, embora a P. aeruginosa disponha de um arsenal de enzimas antioxidantes, a LsfA se destaca por sua alta eficiência na decomposição do peróxido de hidrogênio.
Uma descoberta central do estudo é a interação entre a LsfA e a vitamina C (ascorbato). Em 2007, o grupo de Netto mostrou que o ascorbato pode reduzir o ácido sulfênico formado na oxidação das peroxirredoxinas 1-Cys, desafiando a visão predominante de que essas enzimas dependem exclusivamente da reciclagem por tióis. O estudo, publicado na PNAS, revelou uma nova função da vitamina C como redutor intracelular.
Embora o papel do ascorbato como redutor de Prx ainda não seja totalmente compreendido em sistemas biológicos, as análises estruturais realizadas neste estudo sugerem que o ascorbato interage diretamente com o sítio ativo da LsfA. Essa interação permite a regeneração da enzima após a oxidação, restaurando sua função antioxidante.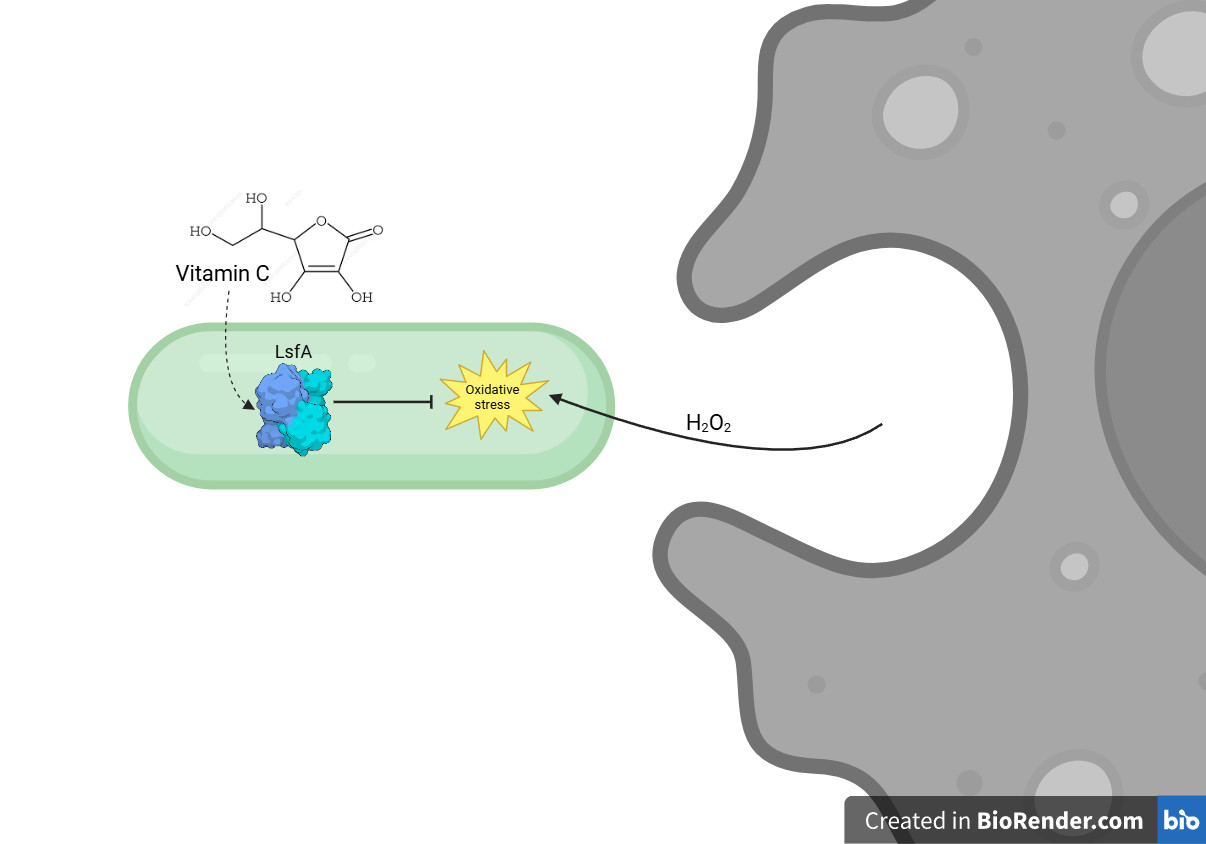
Experimentos com a sonda HyPer7 ajudaram a confirmar a presença de ascorbato dentro da célula bacteriana. HyPer7 é uma sonda fluorescente baseada na proteína verde fluorescente (GFP), cujo brilho se altera na presença de peróxido de hidrogênio, permitindo a detecção dessa molécula dentro das células vivas em tempo real. Os resultados obtidos com a expressão de HyPer7 em P. aeruginosa mostraram que a redução de peróxido de hidrogênio é mais eficiente na presença de LsfA e ascorbato.
“Sabemos que a Pseudomonas não possui vias biossintéticas conhecidas para produzir ascorbato, nem proteínas transportadoras identificadas para sua captação. Ainda assim, com a sonda, conseguimos mostrar não apenas que a atividade de LsfA depende da presença de ascorbato, mas também, de certa forma, que o ascorbato está de fato entrando na célula bacteriana”, afirmou Aleixo-Silva. Os pesquisadores propõem que o ascorbato seja internalizado pela Pseudomonas por meio de células do sistema imune.
O papel da LsfA na resposta da P. aeruginosa ao estresse oxidativo foi investigado por meio da análise de uma cepa bacteriana geneticamente modificada, na qual o gene lsfA foi deletado (cepa ΔlsfA). Os pesquisadores combinaram métodos clássicos, como a contagem de unidades formadoras de colônia após exposição ao peróxido de hidrogênio, com a detecção do oxidante em tempo real, utilizando a sonda fluorescente HyPer7. “Observamos que, na ausência da LsfA, a bactéria se torna mais sensível ao peróxido e menos capaz de neutralizá-lo”, explicou o pesquisador.
Inibidor
Como a LsfA bacteriana possui uma homóloga humana, qualquer inibidor potencial deve ter como alvo apenas a forma bacteriana, sem afetar a humana. Os pesquisadores mostraram que, embora estruturalmente semelhante a outras proteínas Prx6, a LsfA bacteriana apresenta propriedades eletrostáticas distintas, o que significa que os sítios ativos apresentam cargas diferentes. Essas diferenças influenciam a forma como um inibidor interage com cada versão da enzima.
“A vantagem do nosso estudo é que, além de resolver a estrutura, usamos o docking in silico, apara mostrar algumas das interações entre a LsfA e o ascorbato que talvez possam ser mimetizadas por um inibidor,” disse Aleixo-Silva.
Segundo Netto, os próximos passos incluem uma investigação mais aprofundada sobre o metabolismo do ascorbato em P. aeruginosa, bem como estudos usando modelos de macrófagos para avaliar como a exclusão da LsfA afeta tanto a defesa bacteriana quanto as respostas inflamatórias do hospedeiro — uma linha de investigação já apoiada por dados lipidômicos preliminares ainda não publicados.
O artigo Interaction between 1-Cys peroxiredoxin and ascorbate in the response to H2O2 exposure in Pseudomonas aeruginosa, de Rogerio L. Aleixo-Silva, Renato M. Domingos, Madia Trujillo, Fernando Gomes, Luciene O. Machado, Cristiano L.P. Oliveira, Regina Baldini e Luis E.S. Netto, pode ser lido aqui.
