Cientistas descobrem nova via de incorporação do selênio em proteínas
09/12/2024
O selênio é um micronutriente com enorme importância para a saúde humana. Suas funções biológicas são associadas às selenoproteínas, que possuem selenocisteína em sua estrutura. As selenoproteínas geralmente estão envolvidas em funções redox nas células, como as realizadas pela enzima antioxidante vital glutationa peroxidase 4 (GPX4). Esta enzima protege os lipídios das membranas e inibe a morte celular por ferroptose. Assim, o metabolismo da selenocisteína é essencial para a manter a função celular e permitir a vida.
Em uma publicação recente, que foi capa da revista Molecular Cell, uma equipe internacional de pesquisadores anunciou a descoberta de uma nova via para o metabolismo da selenocisteína, mediada pela enzima antioxidante peroxiredoxina 6 (PRDX6). Eles também encontraram uma associação entre níveis elevados de PRDX6 e um subtipo altamente agressivo de neuroblastoma, sugerindo que esse mecanismo pode ser explorado para induzir a ferroptose em células tumorais.
Segundo os autores, este estudo avança o entendimento do metabolismo da selenocisteína e da biossíntese de selenoproteínas, ao revelar uma nova função para a PRDX6. “Até recentemente, acreditava-se que existisse apenas uma via para o metabolismo da selenocisteína. No entanto, para uma célula, ter vias paralelas é importante, pois, se ocorre, por exemplo, uma mutação na selenocisteína liase, a produção de selenoproteínas seria interrompida, tornando a célula mais sensível à ferroptose,” explicou Alex Inague, co-primeiro autor do artigo.
A pesquisa foi liderada por José Pedro Friedmann Angeli, da University of Würzburg, na Alemanha; Sayuri Miyamoto, do Instituto de Química da USP e membro do CEPID Redoxoma; e Hamed Alborzinia, do Heidelberg Institute for Stem Cell Technology and Experimental Medicine e do German Cancer Research Center. Inague realizou a pesquisa durante seu doutorado no IQ-USP, sob a supervisão de Miyamoto, e completou um estágio no laboratório de Angeli. O estudo também envolveu os pesquisadores do Redoxoma Flavia Meotti e Luis E.S. Netto, da USP, além de colaboradores da Alemanha, Estados Unidos e Espanha.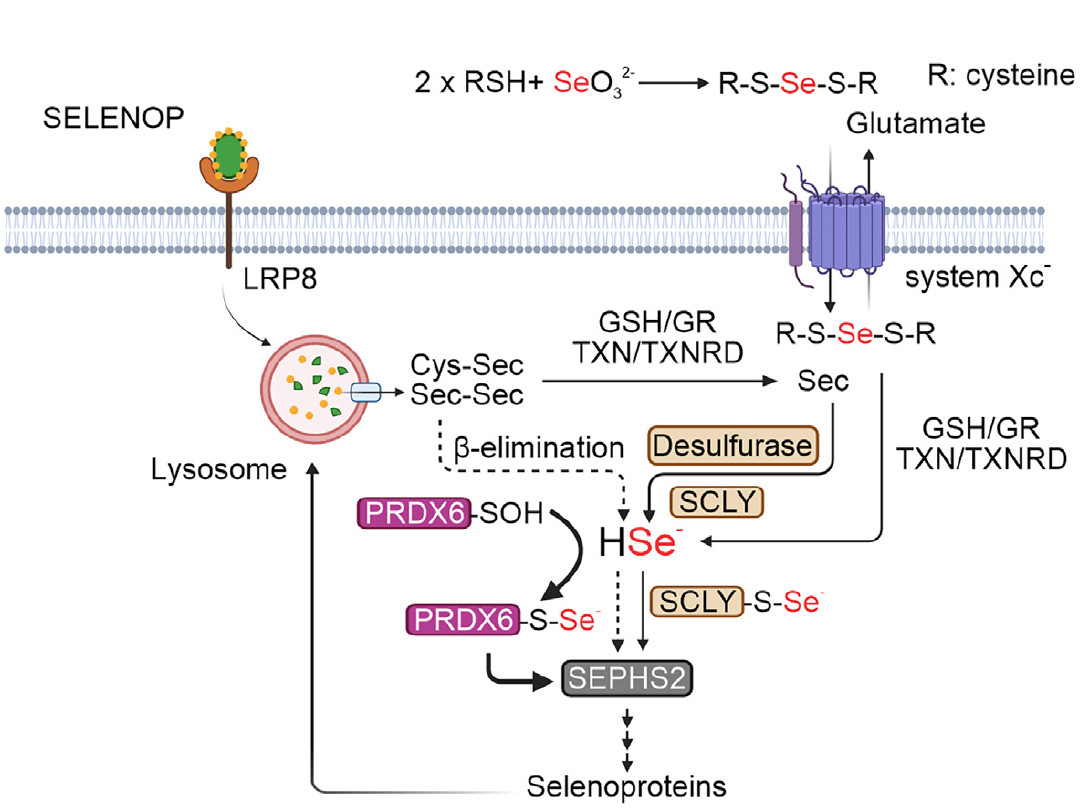
Ferroptose e selenoproteínas
A ferroptose é caracterizada pelo acúmulo de produtos da peroxidação lipídica e catalisada por íons de ferro, resultando em ruptura de membrana e morte celular. “Nossas células precisam de membranas fluidas para para que haja todo um mecanismo regulado de transporte via proteínas entre os meios intra e extracelulares. No entanto, vivemos em um ambiente rico em oxigênio, que gera radicais livres e oxidantes. Os ácidos graxos poli-insaturados das membranas são oxidados, gerando hidroperóxidos de fosfolipídios que, na presença de metais, se quebram, formando mais radicais lipídicos, que propagam reações em cadeia, desestabilizando a membrana,” explicou Miyamoto.
Segundo os pesquisadores, os mecanismos de regulação da ferroptose têm despertado crescente interesse, devido à associação desse tipo de morte celular com várias condições patológicas, incluindo câncer, neurodegeneração e danos aos tecidos. A indução da ferroptose pode ser uma abordagem promissora para tratar certos tipos de câncer, como neuroblastoma, linfoma de células B e melanoma indiferenciado.
Nas células, a principal defesa contra a ferroptose é uma selenoproteína, a GPX4, que protege as membranas contra a oxidação.
As selenoproteínas são raras; apenas 25 foram identificadas no proteoma humano. A selenocisteína é semelhante à cisteína, mas o átomo de enxofre é substituído por selênio. Essa substituição, no entanto, não é simples e são necessárias múltiplas etapas para que ela aconteça.
“A selenocisteína é codificada pelo códon de parada UGA, que geralmente indica o fim da síntese proteica. Se o selênio estiver ausente, a tradução é interrompida e a selenoproteína não é produzida. As células regulam essa recodificação do códon de parada e a expressão de selenoproteínas por meio de um sistema complexo que envolve diversos fatores,” disse Inague.
Isso porque o seleneto é muito instável. “É necessário um mecanismo de transporte eficiente para levar o selênio consumido na dieta até as proteínas que são sintetizadas a partir dele,” afirma Miyamoto.
Durante sua pesquisa, Inague identificou uma correlação entre a PRDX6, enzimas envolvidas no metabolismo do selênio, e níveis de expressão de selenoproteínas como a GPX4. A PRDX6 também reduz hidroperóxidos de fosfolipídios, mas, estudos de cinética mostraram, numa velocidade bem menor que a GPX4.
Com técnicas de triagem e usando a tecnologia de edição genética CRISPR/Cas9 em linhagens de células de neuroblastoma, os pesquisadores descobriram que a PRDX6 atua independentemente de uma enzima chamada selenocisteína liase (SCLY), considerada essencial no metabolismo da selenocisteína.
Por meio de uma série de experimentos com a PRDX6 recombinante, eles demonstraram que a PRDX6 pode se ligar a diferentes compostos de selênio, sugerindo um possível papel no transporte de selênio e uma via alternativa para o metabolismo da selenocisteína.
A PRDX6 é altamente conservada evolutivamente e está presente em vários organismos, desde arqueas e bactérias até humanos. Ela é encontrada praticamente em todos os nossos órgãos, principalmente pulmões, cérebro, fígado, rins e testículos.
Câncer e doenças neurodegenerativas
O neuroblastoma é um tumor que se desenvolve a partir de células do sistema nervoso e afeta principalmente crianças menores de 10 anos. Sua forma mais agressiva é dependente de um receptor da selenoproteína P (LRP8) para supressão da ferroptose e proliferação. Considerando essa dependência, os pesquisadores investigaram o efeito da PRDX6 no neuroblastoma.
Para isso, eles usaram um modelo de xenoenxerto, implantando células de câncer de pacientes em animais para induzir o crescimento tumoral. Células modificadas foram então implantadas na glândula adrenal dos animais. Aqueles com deleção de PRDX6 e SCLY apresentaram tumores reduzidos e sobreviveram por mais tempo em comparação com os animais com as enzimas intactas. Isso sugere que, sem a PRDX6 e a SCLY, a via do selênio fica comprometida, levando à redução da expressão de GPX4 nas células tumorais, que se tornam mais suscetíveis à ferroptose.
No entanto, ainda é prematuro propor a inibição de PRDX6 como abordagem terapêutica. Segundo os autores, são necessários mais estudos para determinar se a PRDX6 poderia servir como alvo para o desenvolvimento de medicamentos.
Por outro lado, impedir a ferroptose também pode ter potencial terapêutico. “Evidências sugerem que a ferroptose pode contribuir para a morte de neurônios motores na esclerose lateral amiotrófica (ELA). Então, é uma via que, se entendermos como acontece, podemos prevenir essa morte por ferroptose. Há dois lados, podemos induzir a ferroptose para fins terapêuticos no câncer ou prevenir a ferroptose e tratar uma doença neurodegenerativa. Então, a gente tenta explorar em ambos os sentidos,” afirmou Miyamoto.
O artigo PRDX6 contributes to selenocysteine metabolism and ferroptosis resistance pode ser lido aqui
