CO2 pode ter papel na sinalização redox
Para além do papel no aquecimento global e de efeitos nocivos na saúde quando em altos níveis, o gás carbônico (CO2) pode ter uma função fisiológica importante, até então pouco investigada, no organismo de mamíferos. Formado continuamente pela respiração – produzimos cerca de um quilo de CO2 por dia –, ele faz parte do par bicarbonato/CO2, nosso principal tampão fisiológico, responsável por manter o pH sanguíneo e celular entre 7,0 e 7,4. Mas o CO2 não é um gás inerte, cujo único papel fisiológico é controlar o pH. Na verdade, o principal tampão fisiológico é ativo nos processos redox, influenciando a sinalização celular.
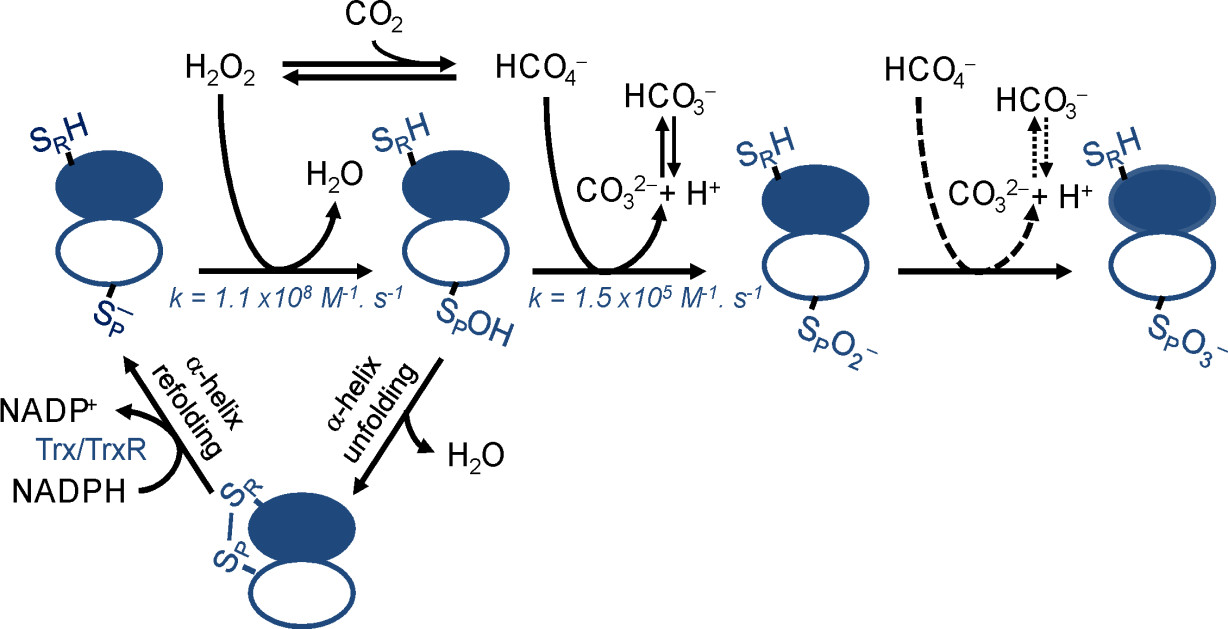
Isso é o que propõem cientistas do CEPID Redoxoma liderados pela professora Ohara Augusto, do Instituto de Química da USP, a partir de um estudo em que em demonstraram que o par bicarbonato/dióxido de carbono aumenta a hiperoxidação da peroxirredoxina 1 (Prx1) humana, por um mecanismo que envolve o peroximonocarbonato, oxidante formado pela reação entre peróxido de hidrogênio (H2O2) e gás carbônico (CO2). Peroxirredoxinas hiperoxidadas perdem a função antioxidante e de transmissor redox, mas passam a ter funções em outras vias de sinalização redox. Os resultados do trabalho foram publicados no Journal of Biological Chemistry (JBC).
“Nossos resultados levantam algumas questões bem interessantes, que envolvem o papel do CO2 na sinalização celular por peróxido de hidrogênio e a versatilidade das peroxirredoxinas. Essas enzimas evoluíram de forma a serem altamente eficientes como antioxidantes. No entanto, principalmente em mamíferos, elas são suscetíveis à hiperoxidação e, com isso, capazes de assumir outras funções. A importância do nosso estudo é demonstrar claramente o mecanismo molecular pelo qual o par bicarbonato/CO2 estimula essa hiperoxidação e, assim, mostrar que o CO2 pode influenciar a sinalização celular. Mecanismos redox são o foco do CEPID Redoxoma”, afirmou Ohara Augusto.
Existem seis Prxs humanas (Prx1 a Prx6), classificadas em três subgrupos (2-Cys, 2-Cys atípica e 1-Cys), que variam em sua localização intracelular e nos mecanismos catalíticos. A Prx1 2-Cys investigada neste estudo é encontrada no citosol de células de mamíferos. A função antioxidante das peroxirredoxinas em plantas, animais e bactérias é decompor peróxidos, principalmente o peróxido de hidrogênio. Como transmissor redox, essas enzimas, ao serem oxidadas pelo peróxido de hidrogênio, oxidam outras proteínas, transmitindo assim o sinal e permitindo que outras moléculas “sintam” o peróxido.
O peróxido de hidrogênio, H2O2 ou água oxigenada, é um poderoso oxidante de dois elétrons, continuamente produzido em nosso organismo a partir do escape de elétrons da cadeia de transporte durante a respiração mitocondrial e por reações catalisadas por várias oxidases, como NADPH oxidases (NOX), xantina oxidase (XO) e monoamina oxidase (MAO). Ele é usado por células do sistema imune, como neutrófilos, para produzir ácido hipocloroso e atacar microrganismos invasores, combatendo infecções. Por ser uma molécula estável e com grande capacidade de difusão, o H2O2 é considerado um sinalizador na comunicação entre as células. A regulação fina dos níveis de H2O2 pelas Prxs 2-Cys, consideradas sensores deste peróxido, pode estar relacionada com processos como supressão de tumores, diferenciação neuronal e doenças cardiovasculares.
Curiosamente, segundo os pesquisadores, quando há excesso de H2O2, as peroxirredoxinas de eucariotos podem ser hiperoxidadas. A hiperoxidação é o processo no qual H2O2 oxida o ácido sulfênico resultante da oxidação da cisteína peroxidásica da Prx a derivados sulfínicos e sulfônicos. As enzimas Prxs nessas formas não são recicladas por redutores, o que inativa sua atividade peroxidásica e de transmissor redox. Dentre outras possíveis funções, as Prxs 2-Cys hiperoxidadas passam a potencializar as vias de sinalização que dependem da oxidação mediada pelo H2O2 de proteínas que contêm cisteínas menos reativas do que a cisteína peroxidásica das peroxirredoxinas.
“Nossos dados mostram que, na presença do par bicarbonato/CO2, o desvio para hiperoxidação da peroxirredoxina é maior do que apenas em presença do peróxido de hidrogênio. Isso nos levou a investigar qual seria a ação do CO2 nesse aumento”, explicou a professora Daniela Ramos Truzzi, também do Instituto de Química da USP e do CEPID Redoxoma, primeira autora do artigo.
O par bicarbonato/CO2 e a produção de oxidantes
Animais submetidos a altas tensões de CO2 apresentam distúrbios nos pulmões, no sistema cardiovascular e no sistema nervoso. Níveis elevados de CO2 também ocorrem em situações clínicas como enfisema, paralisia dos músculos respiratórios e fibrose pulmonar. Estas condições clínicas geralmente estão associadas a danos oxidativos, mas a relação entre esses danos e os níveis de CO2 tem sido pouco considerada.
O quadro começou a mudar com a descoberta do peroxinitrito, um potente oxidante derivado do óxido nítrico, que tem o CO2 como um dos seus principais alvos biológicos. “Essa foi a primeira demonstração clara de que o CO2 poderia participar de reações de oxidação. Meu grupo contribuiu bastante para demonstrar que a reação entre peroxinitrito e CO2 gera o radical carbonato, que é o segundo oxidante biológico mais potente depois do radical hidroxila. Com isso, constatamos que o CO2 é responsável pelos efeitos deletérios do peroxinitrito e, portanto, do óxido nítrico”, explicou Ohara Augusto. Segundo a pesquisadora, isso renovou o interesse nos papéis patogênicos dos oxidantes derivados do principal tampão fisiológico, o par bicarbonato/dióxido de carbono.
“Em relação ao CO2, podemos fazer uma analogia com o oxigênio, que é uma molécula fundamental para processo vitais e, no entanto, tóxica”, afirma.
Em 2007, o grupo de Augusto publicou um artigo de revisão sobre oxidantes derivados do tampão bicarbonato, no qual dava ênfase tanto ao radical carbonato quanto ao peroximonocarbonato, um oxidante cuja existência em equilíbrio com H2O2 e com o par bicarbonato/dióxido de carbono é conhecida pelos químicos desde os anos 1980, mas que não despertava muito interesse na biologia. O trabalho ajudou a aumentar esse interesse, mas o grupo se concentrou nos efeitos deletérios do par bicarbonato/CO2. Em 2016-2017, Augusto e Truzzi escreveram um capítulo de livro no qual enfatizavam a possível participação do peroximonocarbonato nas oxidações biológicas, principalmente na oxidação de resíduos cisteína de proteínas.
Segundo Truzzi, “essa análise crítica da literatura, publicada em 2018, e o fato de que H2O2 e CO2, os precursores do peroximonocarbonato, são continuamente produzidos nas células, nos levaram ao estudo agora publicado. Fizemos experimentos in vitro, usando técnicas como immunoblotting, cinética e espectrometria de massas. E os nossos dados indicam que o peroximonocarbonato é o intermediário que estimula a hiperoxidação da Prx1 humana”.
Ohara ressalta que, em um artigo publicado recentemente também no JBC, a pesquisadora neozelandesa Christine Winterbourn e colaboradores mostraram em células que o par bicarbonato/CO2 aumenta a inativação da fosfatase envolvida na sinalização mediada por EGF (epidermal growth fator), e também propôs que seria por ação do peroximonocarbonato. “Acredito que o impacto desses dois trabalhos publicados quase ao mesmo tempo seja demonstrar que o CO2 influencia a sinalização redox e que o peroximonocarbonato é um oxidante biológico importante, que precisa ser melhor investigado”, afirmou.
O artigo The bicarbonate/carbon dioxide pair increases hydrogen peroxide-mediated hyperoxidation of human peroxiredoxin 1, de Daniela R. Truzzi, Fernando R. Coelho, Veronica Paviani, Simone V. Alves, Luis E. S. Netto e Ohara Augusto, pode ser lido aqui.
