Revelado novo mecanismo para formação de metabólitos do óxido nítrico no organismo
O óxido nítrico (NO∙) é um radical livre gasoso produzido naturalmente por nosso organismo. Ele está envolvido em vários processos fisiológicos e patológicos e desempenha papéis importantes na vasodilatação, na inflamação e na resposta imune. O metabolismo do óxido nítrico gera nitrito, peroxinitrito, dinitrosilo complexos de ferro (DNIC, na sigla em inglês) e nitrosotióis. Dentre estes derivados, os DNICs são os mais abundantes no meio intracelular e presumivelmente têm funções fisiológicas que vêm sendo intensivamente estudadas, inclusive seu papel na S–nitrosação de proteínas.
Em artigo publicado na revista Chemical Communications, da Royal Society of Chemistry, a professora Daniela Ramos Truzzi, do Departamento de Bioquímica do Instituto de Química da USP e do CEPID Redoxoma, descreveu o mecanismo de formação de dinitrosilo complexos de ferro (DNICs), identificando radicais tiila, detectados por ressonância paramagnética eletrônica (EPR), como coprodutos desse processo. Os resultados da pesquisa indicam uma nova rota para a formação de nitrosotióis.
“A literatura já mostrava que o aumentos nos níveis celulares de DNIC são concomitantes ao aumento nos níveis de nitrosotióis e se acreditava que os DNICs, depois de formados, promoviam a S–nitrosação de biotióis, mas não havia uma explicação para isso. Nosso trabalho mostra que a própria síntese de DNIC gera radicais tiila em um ambiente rico em óxido nítrico, e, nessa condição, é inevitável que ocorra a reação de nitrosação. É a primeira vez que se mostra que o mecanismo de formação de DNIC pode levar à formação de nitrosotióis”, afirmou Truzzi, que realizou parte do trabalho na University of California, em Santa Barbara, nos Estados Unidos, em um pós-doutorado sob a supervisão do químico Peter C. Ford.
A S–nitrosação é uma modificação pós-translacional que consiste na adição de um grupo nitroso a um tiol, afetando a atividade de proteínas de diferentes classes funcionais e influenciando vários processos fisiológicos. Tióis são compostos orgânicos de enxofre da forma R–SH. Tiol-proteínas (Cys–SH) têm sido cada vez mais estudadas como adaptadores redox que regulam alvos moleculares específicos, exercendo múltiplas funções celulares. Desta forma, a S–nitrosação de proteínas também pode ser considerada como um mecanismo de sinalização redox dependente de óxido nítrico.
DNICs e S–nitrosação
Um grande número de estudos recentes tem mostrado a ocorrência de S–nitrosação em células e tecidos, associada a uma série de processos fisiológicos, como homeostase vascular, autofagia e resposta imune. A desregulação da S–nitrosação em proteínas tem sido associada a doenças como desordens neurodegenerativas, vários canceres e diabetes.
Como o óxido nítrico não reage diretamente com tióis, vários mecanismos para a formação de nitrosotióis foram sugeridos, e os DNICs, que são considerados reservatórios e carregadores de óxido nítrico, foram propostos como intermediários das reações de S–nitrosação.
Os DNICs são velhos conhecidos dos químicos inorgânicos e têm sido detectados em células e tecidos desde 1965, antes mesmo da descoberta de que o óxido nítrico é produzido endogenamente. Seus papéis fisiológicos são relacionados ao óxido nítrico. Já foi demonstrado que eles induzem a vasodilatação, inibem a agregação plaquetária, aceleraram a cicatrização de feridas e têm potencial terapêutico. No entanto, segundo Truzzi, a natureza da composição química destes complexos biológicos permanece desconhecida e suas propriedades bioquímicas têm sido pouco exploradas. A pesquisadora explica que o estudo dos DNICs é um trabalho de interface entre a bioquímica e a química inorgânica.
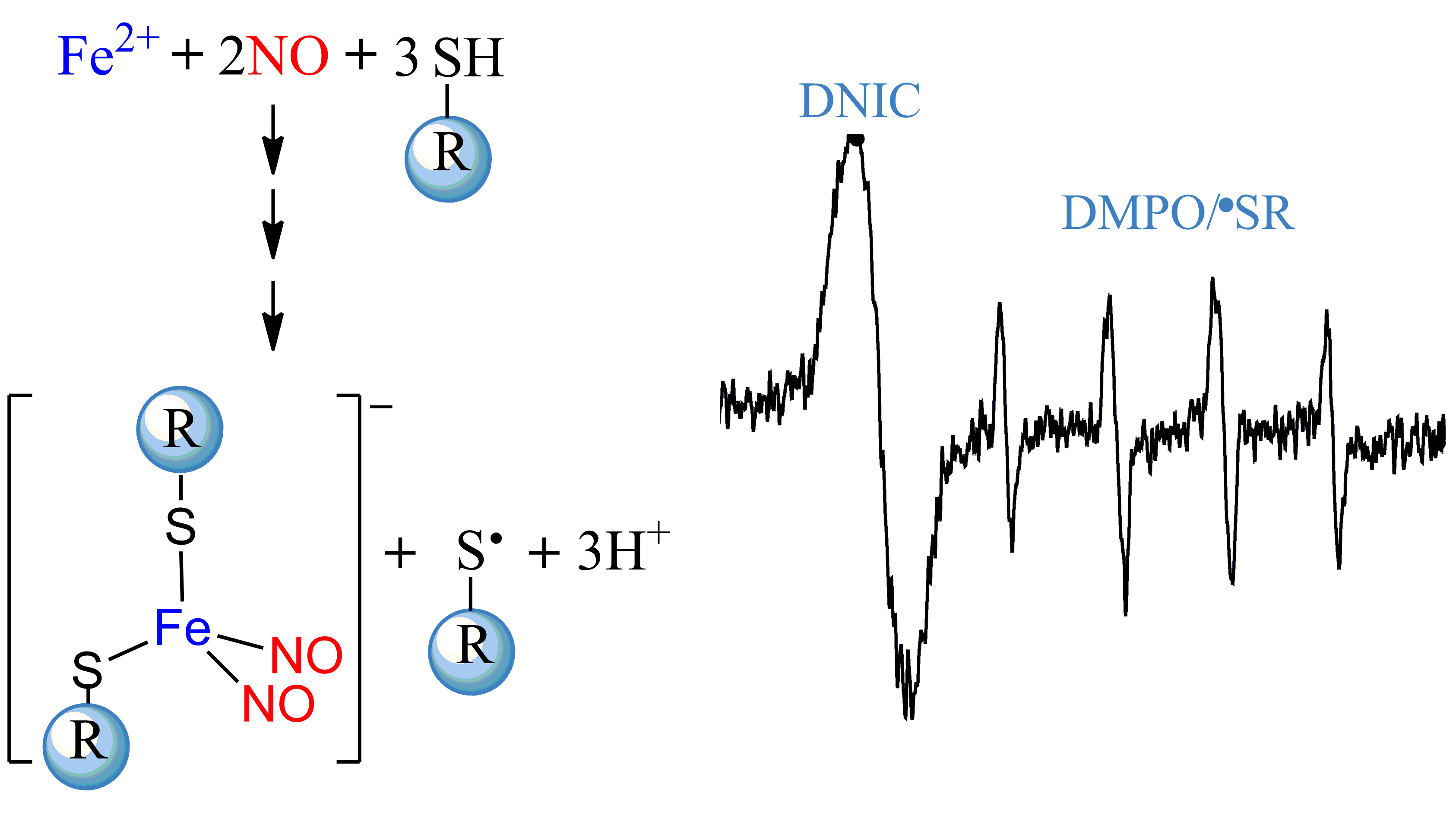
Para investigar o mecanismo de formação do complexo, os pesquisadores trabalharam com cisteína e glutationa, que são tióis de baixo peso molecular abundantes nas células, além do ferro e do óxido nítrico. Os experimentos foram feitos em ausência de oxigênio, para evitar reações secundárias, e em meio aquoso, em pH 7,4, que se aproxima de condições fisiológicas. “Como as reações são muito rápidas — em 140 milissegundos já vemos o que está acontecendo —, usamos uma cavidade de fluxo no EPR, em que as soluções são misturadas e rapidamente direcionadas ao detector”, explicou a pesquisadora. “Partimos do ferro II e o complexo final é formado por ferro I, porque ocorre uma reação de oxidorredução, na qual o ferro é reduzido e o tiol é oxidado. Para identificar o radical tiila, usamos captadores de spin, que são moléculas que se ligam a radicais específicos tornando-os mais estáveis e permitindo sua detecção”. Também foram realizados estudos cinéticos, ainda não publicados.
Segundo a pesquisadora, o próximo passo é estudar proteínas, cuja complexidade estrutural propicia um ambiente químico variado, podendo conferir uma maior especificidade para a formação de nitrosotióis.
O artigo Thiyl Radicals Are Co-products of Dinitrosyl Iron Complexes (DNICs) Formation, de Daniela R. Truzzi, Ohara Augusto e Peter C. Ford, pode ser lido neste link
