Os múltiplos papéis fisiológicos de uma proteína redox
Um dos aspectos fascinantes da biologia redox — e ao mesmo um dos maiores desafios ao entendimento desses processos — é o fato de que intermediários relativamente pouco complexos do ponto de vista bioquímico podem efetuar funções celulares elaboradas e finamente reguladas. Neste sentido, tiol-proteínas têm sido cada vez mais estudadas como adaptadores redox capazes de traduzir reações redox na regulação de alvos moleculares específicos, exercendo múltiplas funções celulares. Uma dessas tiol-proteínas, abordada de várias formas no contexto do CEPID Redoxoma, é a proteína dissulfeto isomerase (PDIA1).
A PDIA1, ou simplesmente PDI, é o protótipo da família das PDIs, contento mais de 20 membros, que pertence à superfamília da tiorredoxina. PDI, essencial para a sobrevivência das nossas células, é uma proteína bastante abundante, expressa em quase todos os tecidos de mamíferos. Sua função clássica é catalisar a inserção de pontes dissulfeto em proteínas nascentes no retículo endoplasmático (RE), garantindo seu enovelamento correto essencial à homeostase proteica celular. As pontes dissulfeto, que estabilizam proteínas, são ligações resultantes da oxidação de dois grupos tiol. A PDI também apresenta atividade chaperona, que per se não é diretamente redox-dependente.
A PDI é localizada predominantemente no retículo endoplasmático, mas também, em menores quantidades, na superfície celular, meio extracelular e possivelmente também no citosol e núcleo. A PDIA1 de superfície celular/ extracelular é o pool mais bem caracterizado fora do retículo endoplasmático e regula eventos relacionados à internalização de vírus, trombose, ativação plaquetária e remodelamento vascular. As várias funções da PDI ocorrem em paralelo à sua estrutura característica. Ela é constituída por 508 aminoácidos organizados como uma estrutura em forma de U, que possui domínios sequenciais nomeados –a–b–b’–a’, mais um domínio C-terminal. Os domínios tipo “a” em cada braço do “U” contêm sítios catalíticos redox ativos com motivos CGHC (cisteina, glicina, histidina, cisteina), que permitem que a PDI sofra ciclos de redução-oxidação. Os domínios do tipo “b” na parte inferior do “U” são ricos em resíduos hidrofóbicos envolvidos no reconhecimento e ligação a substratos proteicos.
O grupo do professor Francisco R. M. Laurindo, do Instituto do Coração da Faculdade de Medicina da USP e do CEPID-Redoxoma, tem mostrado ao longo dos anos um envolvimento da PDI fora do retículo endoplasmático em diversas vias de sinalização redox aparentemente independentes de sua função no enovelamento de proteínas. Tais funções incluem a interação com o complexo NADPH oxidase (Nox) e com o citoesqueleto celular; no caso do pool extracelular, o papel da PDI no remodelamento vascular e na mecanotransdução (processo pelo qual as células convertem estímulos mecânicos em uma resposta química). A PDI também tem sido estudada em colaborações entre os grupos que compõem o CEPID Redoxoma, um Centro de Pesquisa, Inovação e Difusão financiado pela FAPESP. Em conjunto, estes dados têm reforçado um papel relevante da PDI na fisiopatologia de distúrbios cardiovasculares e neurodegenerativos, diabetes e câncer.
No início deste ano, o grupo de Laurindo publicou três artigos que expandem o entendimento das múltiplas funções da PDI.
O papel dual da PDIA1 no controle da Nox1 NADPH oxidase no câncer
A produção de oxidantes tanto pode estimular quanto inibir o crescimento tumoral. Oxidantes geram fenômenos que dão origem a tumores, como crescimento celular e migração. Mas, a partir de certo ponto, são responsáveis pela apoptose, que é a morte celular programada, e regressão do tumor. O equilíbrio entre esses dois momentos é delicado.
Sabe-se que a PDI está implicada na progressão do câncer por mecanismos ainda pouco conhecidos. Estudos mostram que a PDI está superexpressada em melanoma, linfoma, carcinoma hepatocelular, câncer de cérebro, rim, ovário, próstata e pulmão. Frequentemente está associada a metástase, invasividade e resistência a medicamentos.
A relação entre a PDI e a produção de oxidantes passa pela NADPH oxidase (Nox), uma família de enzimas que catalisa a redução do oxigênio molecular gerando o ânion radical superóxido, que, por sua vez, participa da geração de outros oxidantes. Vários estudos prévios indicaram que a PDI está envolvida na ativação da Nox, particularmente o subtipo Nox1, em células vasculares.
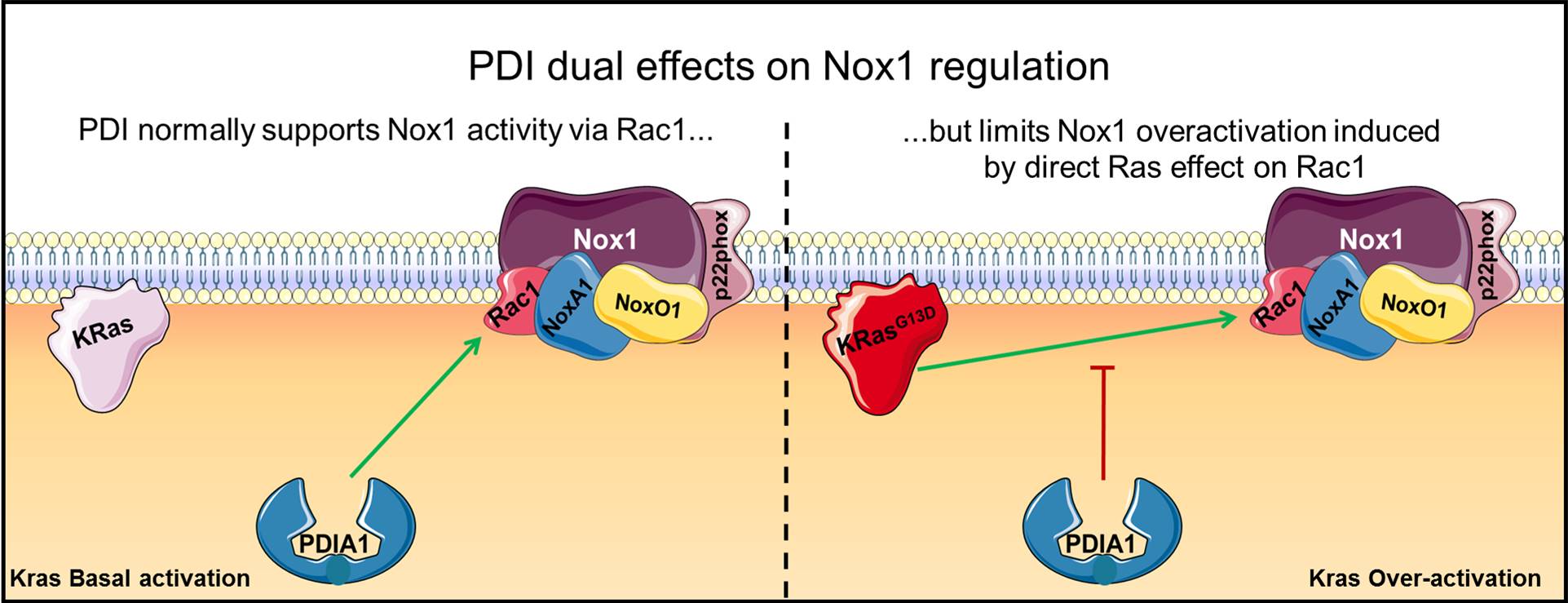
Estudando o câncer colorretal, no qual a Nox 1 tem um papel importante, pesquisadores do grupo de Laurindo observaram um efeito dual da PDIA1 dependente de distintos graus de ativação do oncogene KRas. A pesquisa foi realizada durante o doutorado de Tiphany Coralie De Bessa e os resultados foram publicados na revista Cell Death and Disease.
O efeito dual da PDIA1 está relacionado ao nível de ativação da proteína Ras. A proteína Ras é codificada pelo proto-oncogene Ras, cuja família é formada por três genes associados a várias funções de crescimento e morfologia celulares e que estão envolvidos na carcinogênese em humanos: HRas, KRas e NRas. O KRas é o gene mais mutado no câncer colorretal, sendo um alvo terapêutico. Uma das características da célula com mutação ativadora da KRas é que ela ativa uma série de vias que geram oxidantes, incluindo a NADPH oxidase.
Em células com níveis moderados de ativação de KRas, a PDI sustenta a produção de superóxido dependente da ativação da Nox1, de modo semelhante ao que havia sido observado anteriormente nas células vasculares. No entanto, em células com mutação gerando alta ativação da KRas, a PDIA1 limita a produção do oxidante. O mecanismo deste comportamento envolve o aumento associado da atividade da Rac1, que é uma subunidade da Nox1.
Nas células com níveis normais ou moderados de atividade da KRas, “a PDI sustenta a ativação da Nox1 por uma via dependente de uma interação com Rac1, o que já tínhamos visto nas células vasculares anteriormente. Porém a novidade deste estudo é que parece haver um teto para este efeito, isto é, a PDI, ao mesmo tempo em que ativa a Nox1, impõe uma espécie de limite máximo de ativação, e este teto parece estar associado ao grau de ativação da Rac1”, explica Laurindo. Rac1 e RhoA pertencem à família das pequenas proteínas sinalizadoras Rho GTPases, que atuam como interruptores moleculares, particularmente de processos ligados ao citoesqueleto.
Quando a Rac1 é ativada em excesso por um mecanismo independente da PDI, no caso uma ativação direta pela KRas, o teto imposto pela PDI é desativado e a Nox1 continua ativa, de modo que neste caso a PDI passa a ser um supressor deste processo. Dentre as vias de sinalização envolvidas nestes processos, os pesquisadores mostraram associação com as proteínas Stat3 e GSK3-beta.
Segundo os pesquisadores, a PDIA1 pode atuar como um mecanismo regulador da produção de oxidantes pela Nox1 em tumores. Potencialmente, a supressão da produção de oxidantes pela maior expressão da PDI em tumores com mutações da KRas poderia estar associada a mecanismos de escape tumoral.
PDI no plasma humano: um novo marcador de função endotelial
Embora não se saiba ao certo como a PDI chega à superfície da célula e é secretada, efeitos do pool extracelular dessa proteína em trombose e no remodelamento vascular são conhecidos. Mas será que de fato existe um pool de PDI plasmática circulante em humanos?
Essa foi a primeira pergunta que orientou a pesquisa realizada durante o doutorado de Percíllia Victória S. de Oliveira, cujos resultados foram publicados na revista Redox Biology. Anteriormente, Oliveira e Laurindo publicaram uma extensa revisão sobre as implicações em doenças do pool de tiol/dissulfeto circulante no plasma.
Para responder à questão, os pesquisadores usaram e validaram um ensaio ELISA para detecção específica de PDI no plasma de 35 voluntários saudáveis. Eles detectaram e quantificaram a proteína circulante, e descobriram que a variabilidade nas concentrações de PDI é alta entre indivíduos, mas surpreendentemente baixa no mesmo indivíduo ao longo do tempo e em diferentes condições.
Segundo os pesquisadores, este comportamento das concentrações plasmáticas indica que estas podem ser janelas para revelar um padrão individual de assinatura de proteínas plasmáticas. “Pensando no papel da PDI na homeostase do sistema, faz sentido encontrar um nível individual constante da proteína, como se ela fosse um indicador de fenômenos homeostáticos que ocorrem na parede vascular. Detectamos picogramas de PDI, o que indica que talvez ela não tenha de fato efeitos biológicos, mas seja um marcador de outras proteínas presentes no plasma”, afirmou Laurindo.
Para investigar essa hipótese, as amostras de plasma humano foram classificadas em dois grupos: plasma rico em PDI e plasma pobre em PDI, com base na mediana de 330 pg/ml, e foram submetidas a análise proteômica.
Com base nos estudos de proteômica, os pesquisadores identificaram uma maior presença de proteínas relacionadas a trombose, fenômenos imunes e inflamação nos plasmas pobres em PDI. No plasma rico em PDI, encontraram proteínas associadas ao citoesqueleto e a fenômenos de manutenção celular. Não foram encontradas correlações entre os níveis de PDI e fatores de risco tradicionais, como colesterol, triglicérides e proteínas C reativas, bem como com função plaquetária.
Indo além, os pesquisadores mostraram que tais assinaturas proteicas estão correlacionadas com a função endotelial, ao reproduzirem os resultados in vitro, incubando células endoteliais cultivadas com os respectivos plasmas. “Foi interessante porque conseguimos reproduzir um perfil de expressão gênica nessas células bastante na linha do que havíamos observado nos dados da proteômica plasmática,” disse o pesquisador. Genes relacionados a apoptose, resposta imune e coagulação sanguínea estavam mais ativados nas células com plasma pobre em PDI e inibidos naquelas incubadas com o plasma rico na proteína. Também as assinaturas proteômicas do secretoma das células incubadas com os diferentes plasmas foram concordantes com as correspondentes assinaturas plasmáticas.
O passo seguinte foi investigar se tais assinaturas se traduziam em respostas funcionais. Os pesquisadores constataram que o plasma pobre em PDI promove o comprometimento da adesão endotelial à fibronectina, uma proteína de matriz extracelular, e um padrão perturbado de migração celular, que acarreta menor capacidade de reparar uma lesão endotelial.
Migração de células endoteliais expostas ao plasma rico em PDI [↖], ao plasma pobre em PDI [→] e controle (FBS) [↑].
|
Um dado interessante, obtido a partir da avaliação dos níveis de PDI de amostras de plasma coletadas em um banco de dados validado de uma população composta por indivíduos com doença vascular clinicamente evidente, é que pacientes com eventos cardiovasculares apresentam níveis mais baixos de PDI em relação a indivíduos saudáveis.
“É importante frisar que não estamos dizendo que descobrimos um novo biomarcador. Nosso trabalho é essencialmente uma investigação conceitual, sendo o primeiro estudo a apontar a PDI como repórter de uma assinatura proteômica específica do plasma. De certa forma foi surpreendente descobrir que existem assinaturas proteômicas em pessoas aparentemente sadias de modo independente de outras variáveis conhecidas de risco cardiovascular, com efeitos biológicos diretos do plasma e possíveis respostas endoteliais associadas.”
pecPDI, mecanoadaptação e células bêbadas
Foi o grupo de Laurindo que propôs a denominação pecPDI para PDI extracelular, que pode ser secretada (peri) ou de superfície (epicelular) — PDI peri/epicelular, pecPDI. Em seu doutorado, o pesquisador Leonardo Y. Tanaka mostrou o envolvimento da pecPDI no remodelamento vascular e investigou o papel da proteína em mecanoresposta, que é uma resposta de adaptação a uma força mecânica envolvendo o citoesqueleto celular.
Mas a PDI seria um mediador inflamatório inespecífico ou ela tem um efeito direto na organização celular, isto é, agindo no citoesqueleto? Tanaka avançou esse estudo durante o pós-doutorado, analisando vários modelos de remodelamento de citoesqueleto e mostrando que em todos eles a pecPDI tem um papel importante na regulação da organização fina do citoesqueleto e de vários processos que dependem dessa organização.
Os resultados desta pesquisa foram publicado na revista American Journal of Physiology-Heart and Circulatory Physiology e Leonardo Y. Tanaka é o autor correspondente do artigo.
O citoesqueleto é responsável pela manutenção da estrutura e da organização interna das células, permitindo que elas exerçam funções essenciais, como divisão celular e movimento.
Uma das abordagens utilizadas no estudo foi a distensão mecânica cíclica, que imita as forças sofridas pelos vasos no organismo. Estes experimentos permitiram aos pesquisadores constatar, em células musculares lisas vasculares, que a neutralização da pecPDI desorganiza o citoesqueleto e perturba significativamente o reposicionamento celular. Também, em colaboração com pesquisadores do Instituto de Física da USP, utilizaram microscopia de tração para mostrar que a pecPDIA1 organiza a distribuição de força intracelular.
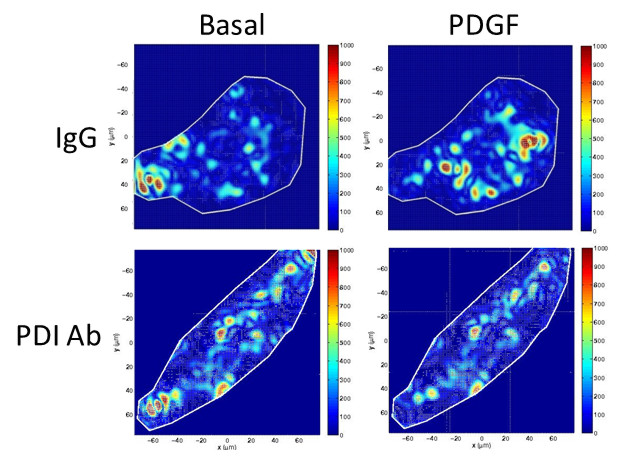
Imagem: Leonardo Y. Tanaka
“As células nas quais a PDI está inibida não conseguem estabelecer o momento contrátil, o que se correlaciona com a capacidade piorada de fazer migração. A célula na qual a PDI total foi inibida por silenciamento gênico perde completamente a capacidade de movimento ordenado, isto é, não migra nada. A célula na qual só a pecPDI é inibida é capaz de trafegar por uma distância normal, mas tem a propriedade de persistência alterada. Isto é, ela não consegue persistir na mesma direção, fica como se estivesse bêbada, perde a regulação fina do direcionamento celular durante a migração,” explicou Laurindo.
Os pesquisadores investigaram dois mecanismos principais de ação da pecPDI na organização do citoesqueleto celular. Um deles é a interação da proteína com as integrinas, que são moléculas de adesão que ligam o citoesqueleto à matriz extracelular e são reguladas pela oxidação de seus tióis pela PDI. E outro seria a ativação da Rhoa em locais específicos da célula.
Dentre as proteínas que atuam sobre o citoesqueleto estão as RhoGTPases. Para migrar, a célula depende da coordenação temporal e espacial de vários processos que permitem que ela se mova de forma eficiente. Para se mover, a célula faz uma série coordenada de adesões e desadesões, alternadamente em distintos locais: isto é, adere na frente e solta atrás, depois adere atrás e solta na frente, para poder esticar, e repete o processo. Esse balanço é regulado pela RhoGDI, que governa a sequência e o local de ativação da Rac1 e RhoA. Os pesquisadores demonstrarm, utilizando um sensor fluorescentede ativação da RhoA, que a pecPDI tem um papel na regulação da polarização da RhoA.
“As proteínas RhoA e Rac1 são uma espécie de yin e yang. No local e momento em que uma delas está alta, a outra está baixa. Elas produzem efeitos opostos e isso é muito importante para a célula poder migrar e ter uma direção de migração”, disse Laurindo.
Os resultados obtidos reforçam a ideia de que a pecPDI seja uma organizadora fina do citoesqueleto e o principal pool responsável pela persistência da migração celular.
Em conjunto, estes três estudos somam-se a outras contribuições do CEPID Redoxoma indicando novas funções e novas vias mecanísticas da PDI. Segundo Laurindo, cada vez mais a PDI é um elo investigativo do grupo e uma nova fronteira para o entendimento de como vias redox podem exercer funções celulares finamente reguladas.
O artigo Subverted regulation of Nox1 NADPH oxidase-dependent oxidant generation by protein disulfide isomerase A1 in colon carcinoma cells with overactivated KRas, de Tiphany Coralie De Bessa, Alessandra Pagano, Ana Iochabel Soares Moretti, Percillia Victoria Santos Oliveira, Samir Andrade Mendonça, Herve Kovacic e Francisco Rafael Martins Laurindo, pode ser acessado em https://www.nature.com/articles/s41419-019-1402-y
O artigo Protein disulfide isomerase plasma levels in healthy humans reveal proteomic signatures involved in contrasting endothelial phenotypes, de Percíllia Victória S. de Oliveira, Sheila Garcia-Rosa, Ana Teresa A. Sachetto, Ana Iochabel S. Moretti, Victor Debbas, Tiphany C. De Bessa, Nathalia T. Silva, Alexandre da C. Pereira, Daniel Martins-de-Souza, Marcelo L. Santoro e Francisco R. M. Laurindo, pode ser acessado em https://www.sciencedirect.com/science/article/pii/S2213231719300217
O artigo Peri/epicellular protein disulfide isomerase-A1 acts as an upstream organizer of cytoskeletal mechanoadaptation in vascular smooth muscle cells, de Leonardo Y. Tanaka, Thaís L. S. Araujo, Andres I. Rodriguez, Mariana S. Ferraz, Vitor B. Pelegati, Mauro C. C. Morais, Aline M. dos Santos, Carlos L. Cesar, Alexandre F. Ramos, Adriano M. Alencar e Francisco R. M. Laurindo, pode ser acessado em https://doi.org/10.1152/ajpheart.00379.2018
