Revelado mecanismo de regulação redox da Nox1 em aterosclerose
O estresse oxidativo desempenha um papel importante no desenvolvimento de doenças cardiovasculares como hipertensão e aterosclerose. A principal fonte do radical livre superóxido em células vasculares é a enzima NADPH oxidase 1 (Nox1). Uma das ativadoras da Nox1 é a proteína dissulfeto isomerase (PDI), uma proteína ubíqua com importantes funções fisiológicas, que participa da sinalização e da homeostase redox, sendo sua função mais conhecida o enovelamento de proteínas nascentes no retículo endoplasmático.
Agora, pesquisadores do CEPID Redoxoma liderados pela professora Lucia Rossetti Lopes, do Instituto de Ciências Biomédicas (ICB) da USP, revelaram o mecanismo molecular por meio do qual a PDI ativa a Nox1 em células musculares lisas vasculares (VSMC), demonstrando com isso que a PDI é um importante regulador redox da Nox1 na aterosclerose.
“Nossos dados mostram a interação redox entre cisteínas da PDI e da subunidade regulatória p47phox, que facilita a fosforilação dessa subunidade e a ativação da Nox1. Nós realizamos um estudo de proteômica redox e identificamos os resíduos de cisteína necessários para essa interação,” afirmou a pesquisadora.
O estudo foi realizado em colaboração com os pesquisadores Francis J. Miller Jr., da Duke University e colaborador internacional do Redoxoma; Luis ES Netto, do Instituto de Biociências da USP e membro do Redoxoma; José César Rosa, da Faculdade de Medicina de Ribeirão Preto da USP; e Ralf P. Brandes, da University of Frankfurt. Os resultados foram publicados na revista Arteriosclerosis, Thrombosis, and Vascular Biology.
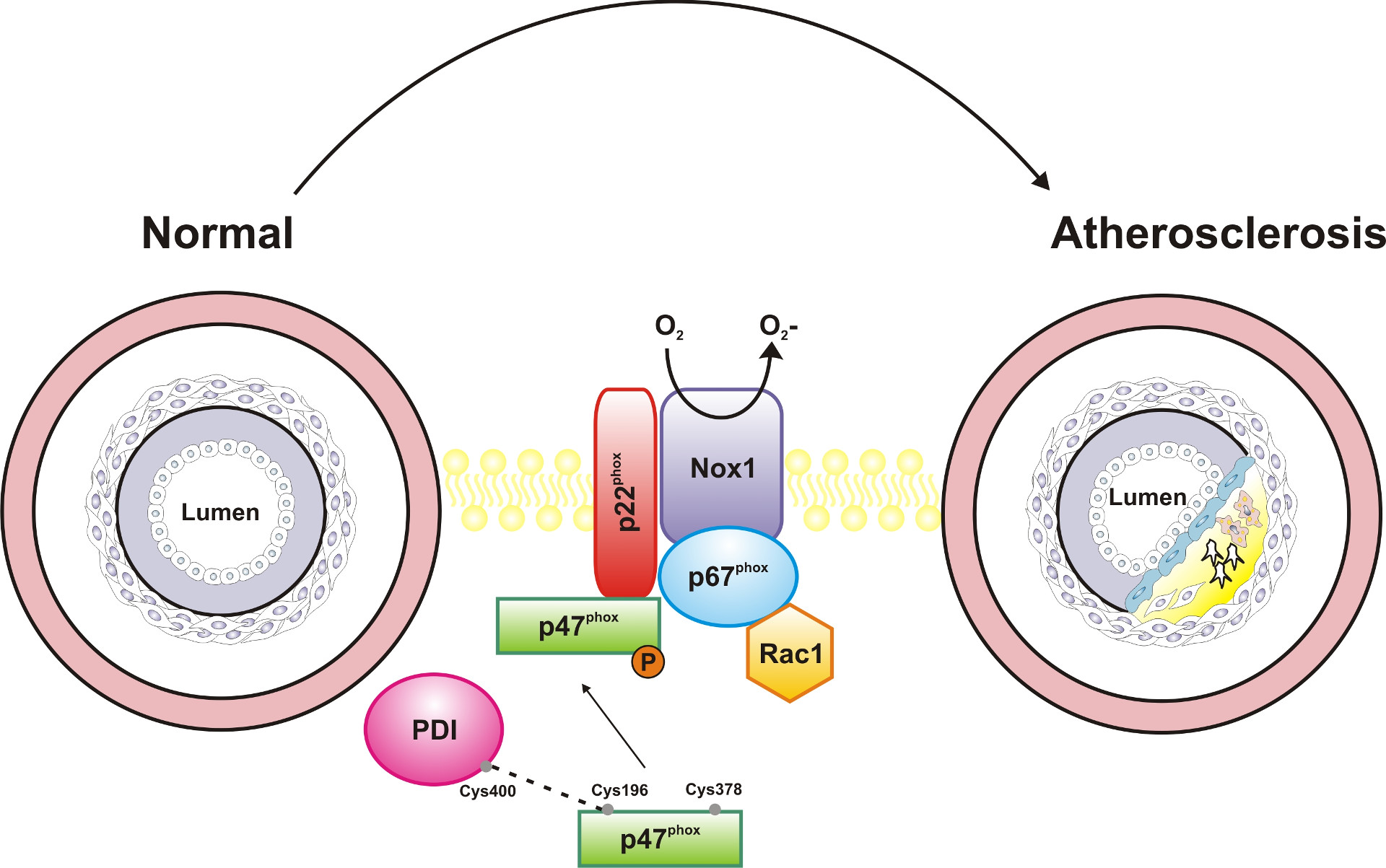
Mecanismo
A NADPH oxidase (Nox) compreende uma família de enzimas ligadas à membrana celular que catalisa a redução do oxigênio molecular gerando o ânion radical superóxido, que, por sua vez, participa da geração de outros oxidantes, como o radical hidroxila e o peróxido de hidrogênio. O complexo enzimático é composto por diversas isoformas, com diferentes funções. A isoforma Nox2, por exemplo, é encontrada em neutrófilos e tem um papel chave no controle de infecções. Já a Nox1, presente no sistema cardiovascular, está envolvida em doenças cardiovasculares. Quando sua expressão é aumentada, como acontece na aterosclerose, o aumento da produção de superóxido provoca a proliferação e migração de células musculares lisas vasculares (VSMC) que contribuem para o remodelamento do vaso.
As Noxes são reguladas por interações proteína-proteína e por moléculas sinalizadoras e são ativadas somente após estímulos fisiológicos apropriados. O sistema Nox contém sete isoformas e as subunidades catalíticas (Nox1 e Nox2) se associam às subunidades regulatórias p47phox e p67phox na presença de um estímulo. Desta forma, na ausência de estímulo as subunidades catalíticas e regulatórias estão localizadas em diferentes compartimentos: as primeiras na membrana e as outras no citosol.
A p47phox é uma subunidade citosólica presente nas Noxes1 e 2. Ela é uma organizadora da Nox e é com ela que a PDI interage, formando pontes dissulfeto entre as cisteínas redox, o que facilita sua fosforilação e, consequentemente, ativa a Nox. Com esses achados, os pesquisadores identificaram um novo mecanismo regulatório por meio do qual a PDI regula a atividade de Nox no sistema vascular.
A fosforilação da p47phox leva ao acoplamento das subunidades citosólicas necessário para montagem e ativação da Nox1 e Nox2. A p47phox é uma carreadora, ela leva outras subunidades para a membrana. De maneira geral essa subunidade organiza a Nox. A p67phox é a subunidade ativadora que se liga na p47phox para chegar à membrana e transferir elétrons do NADPH para o oxigênio molecular. “Estamos mostrando que a PDI pode ser um novo organizador da Nox,” explica Lopes.
Segundo a pesquisadora, para que ocorra a interação entre a PDI e a p47phox, a primeira precisa estar reduzida e a segunda, oxidada. O processo é dinâmico. “Esses estados redox são importantes. Observamos a formação de diferentes pontes dissulfeto, e uma delas é intramolecular, ocorre entre as cisteínas 196 e a 378 da subunidade p47phox. A PDI se liga à p47phox, quebra a ponte intramolecular, provocando uma modificação conformacional da subunidade e expondo a serina 379, que é então fosforilada.” A ponte dissulfeto intramolecular só é observada quando a PDI interage com a p47phox.
No estudo, os pesquisadores mostraram que os níveis de PDI estão aumentados em aortas ateroscleróticas de primatas não humanos. Eles analisaram amostras da artéria aorta de macacos submetidos a uma dieta aterosclerótica, ou seja, rica em colesterol, nas quais já havia sido constatado o aumento da Nox1, e verificaram que também havia um aumento da PDI.
Depois, usando proteínas recombinantes, identificaram uma interação redox entre a PDI e a subunidade citosólica p47phox in vitro. Mutações nas quatros cisteínas redox da PDI impediam a interação com a p47phox , mostrando que a formação do dímero depende destas cisteínas. A formação das pontes dissulfeto redox-dependentes foi confirmada por espectrometria de massa. Os pesquisadores também constataram o papel crítico da cisteína 400 localizada no sítio ativo a’ (redox) da PDI para a ligação com a cisteína 196 da p47phox.
Usando a técnica de ensaio de ligação por proximidade (Proximity ligation assay), eles confirmaram, in vivo, a interação entre a PDI e a p47phox em artérias carótidas de camundongos após lesão causada por arame (wire injury), que é um modelo de remodelamento vascular, semelhante ao que ocorre após a colocação de um stent nas artérias coronárias de um paciente. Por fim, os pesquisadores fizeram um estudo translacional, no qual realizaram uma análise de expressão gênica em artérias com e sem placas de ateroma, a partir de um banco dados obtidos de artérias humanas. Comparando as artérias com e sem lesão, eles observaram que a expressão da p47phox nas placas de ateroma está correlacionada com a expressão de uma PDI que possui o domínio redox a’. Este resultado indica a correlação positiva entre a PDI e a p47phox em artérias ateroscleróticas humanas.
A caracterização da interação entre a PDI e a subunidade p47phox da NADPH oxidase 1 sugere a existência de um pool citosólico de PDI. “Mostrar que a PDI não está somente no retículo endoplasmático é uma contribuição importante do nosso trabalho. Nesse sentido, foi muito importante um trabalho anterior do professor Francisco Laurindo [pesquisador do InCor e do Redoxoma], mostrando o papel de um pool de PDI na superfície celular, denominada pecPDI [proteína dissulfeto isomerase peri/epicelular], na regulação do citoesqueleto vascular”, disse Lopes.
O artigo Redox Activation of Nox1 (NADPH Oxidase 1) Involves an Intermolecular Disulfide Bond Between Protein Disulfide Isomerase and p47phox in Vascular Smooth Muscle Cells, de Marcela Gimenez, Sidney Veríssimo-Filho, Ilka Wittig, Brandon M. Schickling, Fabian Hahner, Christoph Schürmann, Luis E.S. Netto, José César Rosa, Ralf P. Brandes, Simone Sartoretto, Lívia De Lucca Camargo, Fernando Abdulkader, Francis J. MillerJr e Lucia Rossetti Lopes, pode ser lido por assinantes aqui.
