Controlando a morte celular
Em artigo publicado na revista Autophagy, pesquisadores do CEPID Redoxoma liderados pelo professor Mauricio S. Baptista, do Instituto de Química da USP, estabeleceram um paradigma que relaciona danos paralelos em mitocôndrias e lisossomos, modulação de autofagia e eficiência de morte celular fotoinduzida, ao investigar respostas moleculares de células submetidas a oxidação fotossensibilizada.
“Modular a autofagia é uma das estratégias mais inovadoras no desenvolvimento de drogas antitumorais. Nosso estudo é quantitativo e mecanístico e os resultados podem servir para o direcionamento de novas terapias”, afirmou Baptista.
Os resultados do trabalho revelaram detalhes do mecanismo pelo qual o dano paralelo nas membranas de mitocôndrias e lisossomos ativa e inibe a autofagia concomitantemente, sendo uma maneira muito eficiente de causar morte celular. Para provocar dano fotoinduzido específico nessas organelas, os pesquisadores irradiaram queratinócitos humanos normais (HaCaT) e células tumorais tratados com dois compostos fenotiazínicos, azul de metileno (MB) e 1,9-dimetil-azul de metileno (DMMB).
O estudo foi realizado inicialmente como projeto de mestrado de Nayra Fernandes Santos e desenvolvido em parceria com a Dra. Waleska K. Martins, também pesquisadora do CEPID Redoxoma, previamente pós-doutoranda no laboratório e atualmente professora da Universidade Anhanguera de São Paulo.
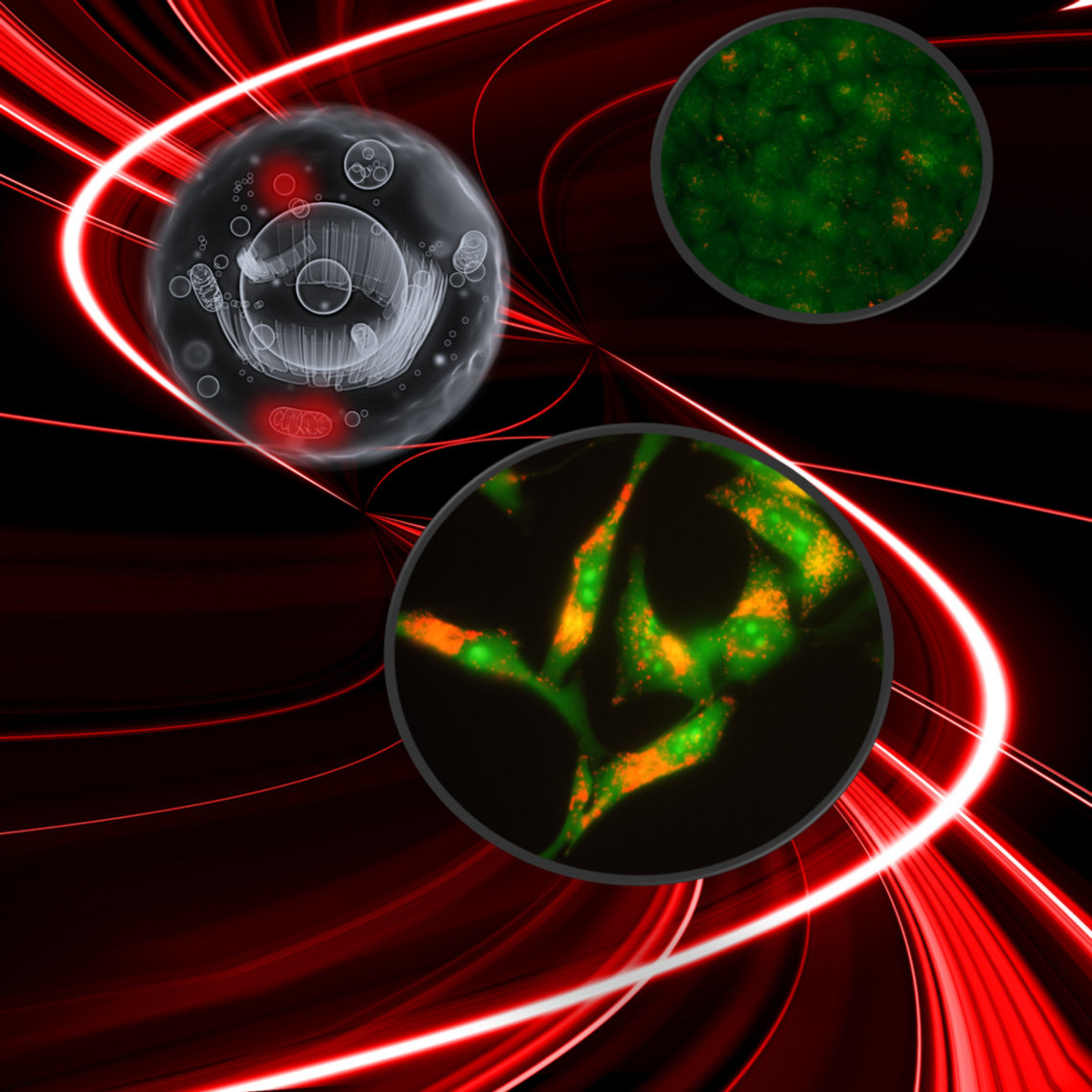

Imagem: Waleska K. Martins
Modulando a autofagia
Células que sofrem oxidações fotossensibilizadas enfrentam um forte estresse redox e contam com mecanismos de autofagia para sobreviver ou morrer. Por meio de um procedimento clínico chamado de terapia fotodinâmica (PDT), a medicina vem usando as reações de oxidação fotossensibilizada para induzir morte celular em tecidos doentes e, consequentemente, para tratar várias doenças com a luz.
A terapia fotodinâmica se baseia na geração de espécies oxidantes citotóxicas, como oxigênio singlete e radical hidroxila, por ativação de um fotossensibilizador pela luz. A autofagia é uma das principais causas da resistência celular aos efeitos oxidativos da terapia.
A autofagia é um processo de degradação e de reciclagem de componentes do citosol e de organelas celulares danificadas, que restabelece a homeostase celular frente a vários tipos de estresse, constituindo-se num mecanismo para a sobrevivência celular. No entanto, ela também pode levar à morte das células e, em várias patologias, pode ter um papel tanto protetor quanto destrutivo.
Em doenças como as metabólicas, neurodegenerativas, infecciosas e no câncer, o processo de autofagia pode estar desregulado. A atividade autofágica ou a inibição dela podem, em determinadas circunstâncias, combater uma doença ou favorecer a patogênese.
Progressos recentes no entendimento da base molecular da autofagia têm revelado estratégias promissoras no tratamento de doenças e, por isso, abordagens farmacológicas para induzir ou inibir a autofagia estão recebendo atenção considerável Por exemplo, a regulação positiva da autofagia pode trazer benefício terapêutico em certas doenças neurodegenerativas, enquanto sua inibição pode ser uma estratégia para tratar alguns tipos de câncer.
Segundo Baptista, a terapia fotodinâmica pode fornecer uma ferramenta para modular a autofagia.
Em 2015, o grupo do pesquisador publicou um artigo na revista Scientific Reports no qual demonstrou que a autofagia se torna um processo destrutivo quando há dano paralelo a membranas de mitocôndrias e lisossomos. Naquele trabalho, os pesquisadores avaliaram danos causados em queratinócitos HaCaT pelos ácidos triterpenóides oleanólico e betulínico.
“Nós observamos que, quando causamos dano nas duas organelas, há uma resposta celular que envolve a ativação de um processo chamado mitofagia, que é a degradação seletiva de mitocôndrias pela autofagia. Na mitofagia, a mitocôndria disfuncional é reconhecida e preparada para ser digerida no lisossomo. Se ao mesmo tempo causamos dano no lisossomo, o processo não é finalizado e isso causa um tipo de morte celular que é conectada com a autofagia” explicou Baptista.
Para detalhar os mecanismos envolvidos na modulação da autofagia, os pesquisadores, desta vez, usaram fotossensibilizadores e luz. Eles compararam o fotodano induzido pelos corantes azul de metileno (MB) e 1,9-dimetil-azul de metileno (DMMB), em queratinócitos humanos normais (HaCaT) e em células tumorais.
Os dois corantes são fotossensibilizadores eficientes, cada molécula de MB e de DMMB gera, respectivamente, 1,71 e 2,25 moléculas de oxigênio singlete por segundo. No entanto, utilizando a técnica de simulação de dinâmica molecular, eles constataram que o DMMB se liga mais nas membranas e causa danos mais especificamente em seus constituintes, enquanto o MB causa um desequilíbrio redox generalizado.
Os resultados mostraram que, em pequenas concentrações (10 nM), apenas o DMMB induziu dano mitocondrial, levando à ativação da mitofagia, que não progrediu para conclusão por causa do dano paralelo no lisossoma, o que desencadeou a morte celular. O fotodano induzido pelo MB foi percebido quase instantaneamente após a irradiação, gerando uma resposta a um estresse oxidativo massivo e inespecífico, em uma faixa de concentração mais alta (2 μM). Neste caso, as células morrem por um mecanismo comum de morte celular por terapia fotodinâmica, que é uma combinação de necrose e apoptose.
Para comprovar a hipótese, os pesquisadores criaram uma condição experimental em que o MB se comportasse de forma semelhante ao DMMB e o mesmo paradigma foi observado.
A conclusão, segundo Baptista, é que “o dano paralelo nas mitocôndrias e nos lisossomos ativa e inibe a mitofagia, levando a uma morte celular tardia e mais eficiente e oferecendo uma vantagem significativa sobre fotossensibilizadores que causam estresse oxidativo inespecífico. A morte celular por fotodano depende, portanto, da extensão da interação do fotossensibilizador com as membranas das organelas e, por sua vez, do nível de dano fotoinduzido nessas membranas”.
Ao testarem também células tumorais, os pesquisadores mostraram que esse processo é mais abrangente e não apenas uma especificidade dos queratinócitos do tipo HaCaT, que são células diferenciadas do tecido epitelial com um mecanismo de autofagia bastante ativo. As células tumorais, em sua maioria, são mais desorganizadas internamente e contam com a autofagia para sobreviver e se proliferar.
Esse é o primeiro exemplo do uso de um fotossensibilizador para modular o eixo mitocondrial-lisossômico de estresse celular. Os pesquisadores acreditam que aprender a controlar a autofagia pode ter um impacto importante no avanço da terapia fotodinâmica e, numa perspectiva mais ampla, no desenvolvimento de tratamentos antitumorais mais eficientes.
O artigo Parallel damage in mitochondria and lysosomes is an efficient way to photoinduce cell death, de Waleska K. Martins, Nayra Fernandes Santos, Cleidiane de Sousa Rocha, Isabel O. L. Bacellar, Tayana Mazin Tsubone, Ana Cláudia Viotto, Adriana Yamaguti Matsukuma, Aline B. de P. Abrantes, Paulo Siani, Luís Gustavo Dias e Mauricio S. Baptista pode ser lido em https://www.tandfonline.com/doi/abs/10.1080/15548627.2018.1515609
