Aldeídos de colesterol podem estar envolvidos em doenças neurodegenerativas
A maior parte do colesterol presente em nosso corpo é sintetizada pelo próprio organismo, sendo apenas uma pequena parte adquirida pela dieta. O colesterol é um tipo de molécula lipídica encontrada nas membranas celulares de todos os mamíferos e é um precursor para a biossíntese de vários hormônios, como cortisol, testosterona e progesterona, dos sais biliares e da vitamina D. Além disso, compõe a mielina, substância que recobre as fibras nervosas, permitindo a propagação rápida dos impulsos nervosos e está presente em altas concentrações no Sistema Nervoso Central.
Mas, como todos os lipídios insaturados, o colesterol pode sofrer oxidações, dando origem a uma variedade de derivados oxidados, conhecidos como oxisteróis. Oxigênio singlete, ozônio e radicais livres oxidam o colesterol, gerando hidroperóxidos, epóxidos e aldeídos, dentre os quais os aldeídos de colesterol 5,6-secosterol (seco A e seco B). Esses aldeídos são moléculas extremamente reativas capazes de modificar proteínas e induzir a formação de agregados.
Estudando um modelo animal de esclerose lateral amiotrófica (ELA), uma doença neurodegenerativa letal, o grupo da professora Sayuri Miyamoto, do Instituto de Química da USP e do CEPID Redoxoma, mostrou que aldeídos de colesterol são onipresentes no córtex motor e na medula espinhal dos animais e que, in vitro, modificam a proteína Cu,Zn-superóxido dismutase (SOD1), que está associada a casos familiares de ELA, levando à produção de agregados de alto peso molecular. Os resultados do estudo foram publicados na revista Redox Biology.
“Nossos resultados são importantes por mostrarem a formação in vivo desse derivado reativo do colesterol no cérebro. A presença de colesterol no cérebro é pouco explorada e temos evidências crescentes, na literatura e nos trabalhos realizados em nosso laboratório, indicando que alterações oxidativas e do metabolismo do colesterol no Sistema Nervoso Central podem estar implicadas em doenças neurodegenerativas e no envelhecimento”, afirmou Miyamoto.
O Sistema Nervoso Central é particularmente rico em colesterol, apresentando uma concentração de cerca de 20 mg/g no cérebro e 40 mg/g na medula espinhal, o que representa cerca de 23% do total de esterol presente no corpo.
Esclerose Lateral Amiotrófica
Considerando a abundância de colesterol no cérebro e na medula e as características dos produtos formados por sua oxidação, os pesquisadores investigaram tanto a presença dos aldeídos de colesterol em tecidos neurais e plasma de modelo de rato com ELA quanto a capacidade deles de induzir agregação da proteína SOD1.
O primeiro passo da pesquisa foi a detecção de secosterol no córtex motor, na medula e no plasma de ratos transgênicos que superexpressam a mutante G93A da SOD1, o que faz com que eles desenvolvam esclerose lateral amiotrófica (ELA). Usando técnicas de cromatografia, os pesquisadores investigaram a presença dos aldeídos em animais doentes e não doentes e também nos estágios sintomático e pré-sintomático da doença.
Os resultados mostraram um aumento significativo na concentração de seco B no plasma de ratos que já apresentavam sintomas de ELA em comparação aos pré-sintomáticos, sugerindo a associação dos aldeídos com a progressão da doença.
No entanto, independente do avanço da doença, os pesquisadores encontraram aldeídos de colesterol, principalmente na forma de seco B, nos tecidos neurais e no plasma de todos os animais analisados. “É uma quantidade ínfima, mas que conseguimos detectar. Parece que existe uma oxidação basal de colesterol acontecendo no Sistema Nervoso Central e isso pode estar envolvido em outras doenças neurodegenerativas além da ELA”, afirmou Miyamoto.
A esclerose lateral amiotrófica (ELA) é uma doença neurodegenerativa que acomete principalmente adultos com idade entre 50 e 60 anos, caracterizada pela disfunção progressiva e morte dos neurônios motores no córtex motor, tronco cerebral e medula espinhal. Não se conhece ainda a causa da doença, mas se sabe que 90 a 95 % dos casos são de origem esporádica e 5 a10%, de origem familiar. Dentre os casos familiares, 20 a 25% são causados por mutações no gene codificador da enzima cobre/zinco superóxido dismutase (Cu/Zn-SOD, ou SOD1).
A SOD1 é uma das mais importantes defesas antioxidantes do organismo e está presente no citosol, núcleo, peroxissomo e espaço entre membranas da mitocôndria de células eucarióticas. Ela é responsável por catalisar a dismutação do radical livre superóxido em peróxido de hidrogênio e oxigênio molecular.
Quando mutada, a SOD1 ganha propriedades tóxicas e pode passar a ter ação pró-oxidante e/ou formar agregados tóxicos para as células. Como em outras doenças neurodegenerativas, o desenovelamento, processo no qual as proteínas perdem sua estrutura tridimensional, e a agregação proteica são marcas registradas da ELA.
Como explica Miyamoto, os aldeídos seco A e seco B podem modificar proteínas específicas no cérebro e levar à formação de agregados. Eles são considerados intermediários importantes na patogênese de doenças cardiovasculares e neurodegenerativas e já foram detectados em amostras de tecido aterosclerótico e em cérebro de pacientes com doença de Parkinson (no caso, envolvidos na agregação da proteína alfa-sinucleína).
Para avaliar o efeito de seco A e B na agregação da SOD1, eles fizeram experimentos in vitro, incubando a SOD1 recombinante com os aldeídos, e constataram que a agregação da proteína foi muito acelerada, atingindo o platô em 12 a 24 horas. Essa ação pode ser atribuída à natureza hidrofóbica dos secosteróis, que aumentam a hidrofobicidade das regiões da proteína às quais se ligam. A formação de agregados acontece pela exposição das superfícies hidrofóbicas de proteínas.
“Comparamos os aldeídos de colesterol com outros aldeídos igualmente derivados da oxidação de lipídios e constatamos que os últimos também modificam as proteínas, mas não levam à agregação. A principal diferença entre eles é quanto à hidrofobicidade”, disse a pesquisadora.
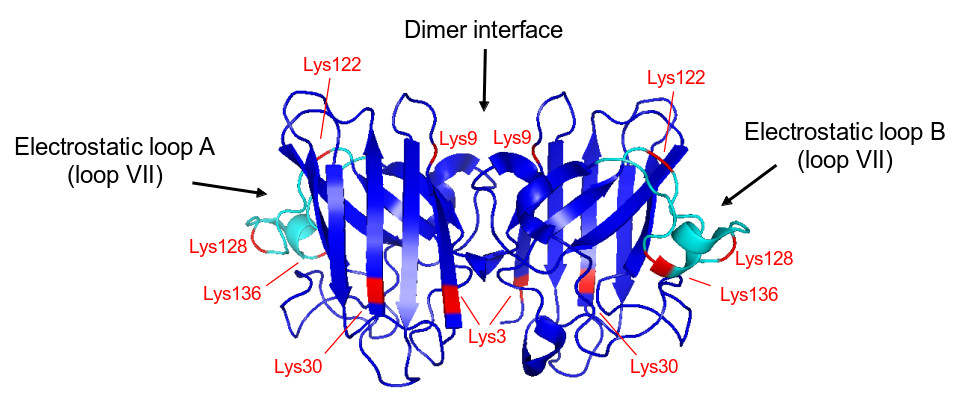
Usando espectrometria de massa para sequenciar os agregados de SOD1, os pesquisadores constataram que o secosterol se liga aos aminoácidos de lisina localizados principalmente no loop eletrostático e perto da interface dos dímeros da proteína, corroborando estudos na literatura que apontam o envolvimento destas regiões em processos de agregação. A SOD1 é composta por duas subunidades idênticas que formam um homodímero por meio de ligações de hidrogênio e interações hidrofóbicas.
Miyamoto afirmou que ainda são necessário estudos para detectar in vivo a presença de adutos SOD1-secosterol, bem como para identificar outros alvos, pois os aldeídos de colesterol podem modificar qualquer proteína localizada nas proximidades de seu local de formação.
O artigo Cholesterol Secosterol Aldehyde Adduction and Aggregation of Cu,Zn-Superoxide Dismutase: Potential Implications in ALS, de Lucas S. Dantas, Adriano B. Chaves Filho, Fernando R. Coelho, Thiago C. Genaro-Mattos, Keri A. Tallman, Ned A. Porter, Ohara Augusto e Sayuri Miyamoto, pode ser lido em https://www.sciencedirect.com/science/article/pii/S2213231718303707
