Estudo mostra que uma classe de ferro celular até então considerada apenas pró-oxidante também pode ser antioxidante
Ferro lábil (LIP, na sigla em inglês para labile iron pool) é uma classe de ferro celular frequentemente considerada pró-oxidante, por estar associada com a produção do radical hidroxila, um radical livre altamente reativo. Agora, pesquisadores do CEPID Redoxoma liderados pelo professor José Carlos Toledo Jr., do Departamento de Química da FFCLRP/USP, demostraram que o ferro lábil também reage com o potente oxidante peroxinitrito, tendo, desta forma, uma ação antioxidante. O trabalho foi publicado no Journal of Biological Chemistry (JBC).
“Nosso trabalho é importante por mudar a caracterização do ferro lábil, que era considerado como espécie exclusivamente pró-oxidante, e, com isso, alertar que, quando se descrevem reações e consequências biológicas envolvendo radicais e oxidantes reativos, a generalização deve ser evitada. Nossos dados mostram que a presença de LIP previne a oxidação promovida pelo peroxinitrito e isso pode fornecer insights sobre processos biológicos que envolvam óxido nítrico, peroxinitrito e LIP”, afirmou Toledo.
O ferro é um elemento essencial na maioria dos processos fisiológicos do organismo humano, sendo uma espécie redox-ativa que alterna entre vários estados de oxidação, principalmente ferroso (Fe2+) e férrico (Fe3+). É encontrado ligado a proteínas de transporte e de armazenamento, como componente funcional de grupos heme- e outras metaloenzimas e na forma lábil. Provavelmente por sua atividade pró-oxidante, sua concentração no organismo é rigidamente controlada em nível tanto sistêmico quanto intracelular.
Os níveis de ferro lábil celular são mantidos por proteínas reguladoras de ferro (IRPs, na sigla em inglês) em uma faixa de baixa concentração que varia de 0,1 a 10 μM, dependendo do tipo de célula, o que corresponde a 0,2 a 3% do ferro total celular.
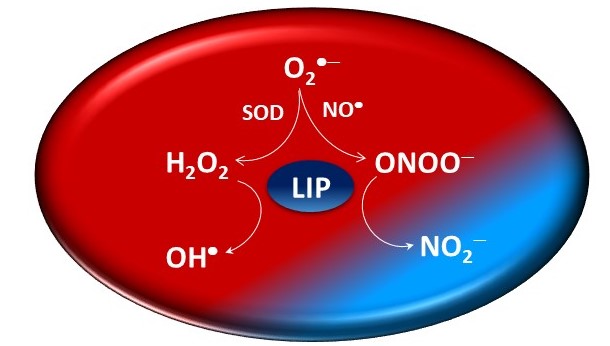
Ferro lábil e peroxinitrito
O ferro lábil já foi chamado de junk iron, porque ninguém conhecia exatamente sua função nas células. Sabia-se apenas que podia reagir com peróxido de hidrogênio formando oxidantes como o radical hidroxila. Também conhecido como ferro quelatável, porque pode ser removido das células por quelantes, o ubíquo LIP ainda é pouco conhecido quimicamente.
Na última década, sua importância começou a ser reconhecida, quando se percebeu que, quando seus níveis eram alterados quimicamente para mais ou para menos, as células respondiam restaurando a concentração anterior. Biologicamente, o LIP representa uma reserva acessível e dinâmica de ferro celular, que trafega entre vários compartimentos celulares e está prontamente disponível para incorporação em metaloproteínas nascentes.
Mas, segundo Toledo, o conceito de reatividade redox do LIP continuou limitado. Por isso, os pesquisadores resolveram estudar a reação entre LIP e peroxinitrito. O oxidante peroxinitrito é um peróxido formado pela reação entre os radicais óxido nítrico e superóxido e tem um papel importante no estabelecimento e progressão de muitas doenças.
Toledo explica que essa reação não foi considerada até então, mas de certa forma ela é esperada, na medida em que os metais estão entre os alvos preferenciais do peroxinitrito e virtualmente todas as espécies químicas que reagem com peróxido de hidrogênio também reagem com peroxinitrito, com constantes de velocidades mais altas. Por exemplo, ebselen, boronato, tióis em geral, peroxirredoxinas e glutationa peroxidases bem como citocromo c peroxidase de levedura reagem com peroxinitrito mais rapidamente do que com peróxido de hidrogênio. A reação entre ferro lábil e peroxinitrito mostrou-se cineticamente competitiva em relação a estes alvos celulares do oxidante. O interessante, afirma ele, é que o produto dessa reação não seja oxidante.
Para investigar a reação entre o LIP e o peroxinitrito, os pesquisadores trabalharam com cultura de células de macrófagos murinos às quais foram adicionados agentes químicos que produzem óxido nítrico e superóxido, que, por sua vez, formam o peroxinitrito. Com o uso de indicadores de oxidação e de nitrosação, eles puderam ver e medir estes processos por espectroscopia de fluorescência. Depois, adicionaram um quelante para remover o LIP e constataram que, sem o LIP, havia mais oxidação e nitrosação.
Eles ainda demonstraram que a nitrosação e a oxidação eram dependentes de peroxinitrito e que os quelantes usados não produziam oxidantes. Por fim, fizeram experimentos em um sistema não celular, nas mesmas condições e usando os mesmos indicadores, e viram que, na ausência de constituintes celulares, incluindo o LIP, a adição do quelante não fazia efeito em oxidação e nitrosação promovidas por peroxinitrito.
Estes dados mostram que o ferro lábil, cuja concentração é bem regulada dentro das células, atua como antioxidante contra peroxinitrito.
O pesquisador ressalta, no entanto, que os resultados obtidos não estão em conflito com dados que apontam os danos causados pela desregulação da homeostase do ferro ou em condições de sobrecarga de ferro. Nestes casos, o ferro pode causar danos oxidativos por sua reação com peróxido de hidrogênio e pode ser decisivo na proliferação de patógenos.
O artigo The labile iron pool attenuates peroxynitrite-dependent damage and can no longer be considered solely a pro-oxidative cellular iron source, de Fernando Cruvinel Damasceno, André Luis Condeles, Angélica Kodama Bueno Lopes, Rômulo Rodrigues Facci, Edlaine Linares, Daniela Ramos Truzzi, Ohara Augusto e Jose Carlos Toledo Jr., pode ser lido por assinantes neste link.
