Estudo detalha oxidação da proteína dissulfeto isomerase (PDI) por peroxinitrito
A proteína dissulfeto isomerase (PDI) é uma proteína ubíqua que desempenha importantes funções fisiológicas, participando da sinalização e da homeostase redox, sendo que sua função mais conhecida é o enovelamento de proteínas nascentes no retículo endoplasmático. Mas ela pode se tornar disfuncional por modificações pós-tradução, incluindo aquelas promovidas por oxidantes biológicos. Sua disfunção tem sido associada a várias doenças nas quais o estresse oxidativo desempenha um papel, como as cardiovasculares e as neurodegenerativas. Embora estudos proteômicos já tenham detectado a PDI nitrada, S–nitrosada e carbonilada em amostras biológicas de humanos e de animais experimentais, a cinética e os produtos da reação da proteína com oxidantes biológicos ainda não haviam sido bem caracterizados.
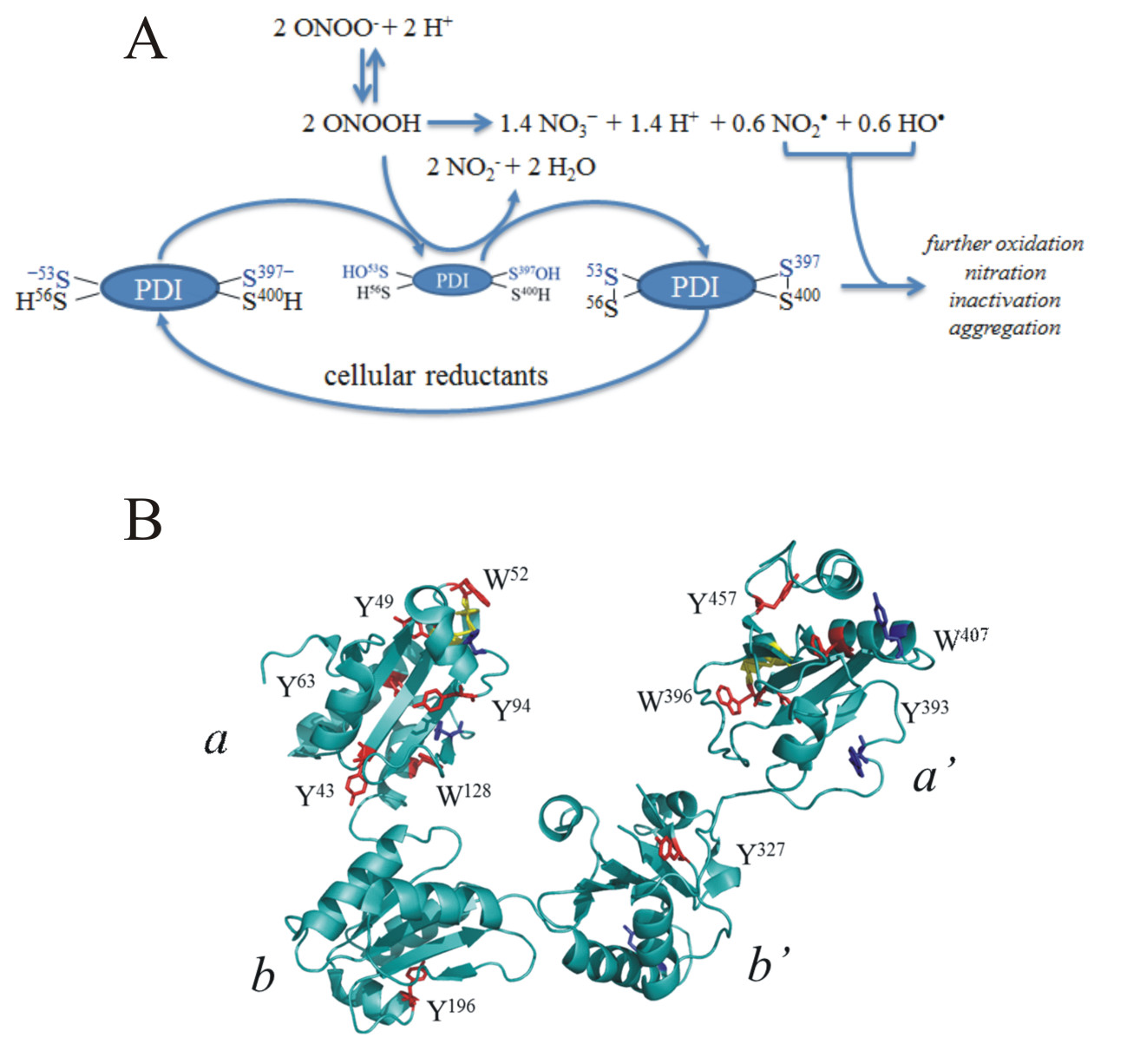
Agora, pesquisadores do CEPID Redoxoma liderados pela professora Ohara Augusto, do Instituto de Química da USP, mostraram que a cinética da oxidação da PDI por peróxidos biológicos pode ser obtida por medidas do decréscimo da fluorescência intrínseca da enzima quando suas cisteínas redox são ativadas. Aplicando esta e várias outras metodologias, eles demonstraram que as cisteínas reativas da PDI (C53 e C397) reagem com o peroxinitrito com velocidades similares e consideráveis, produzindo ao final os dissulfetos correspondentes (C53–C56 e C397–C400). O estudo foi publicado no Journal of Biological Chemistry (JBC).
“Essa reação pode servir como uma via de detoxificação para peroxinitrito em ambientes ricos em PDI, como o retículo endoplasmático”, afirmou a pesquisadora, acrescentando que, “como a PDI está envolvida em eventos de sinalização e eventos de dano celular, esse estudo pode contribuir para a elucidação do mecanismo patogênico de várias doenças.”
Os resultados do estudo também indicaram que repetidos ciclos de catálise da detoxificação do peroxinitrito resultam no acúmulo de modificações oxidativas não reparáveis na PDI, perturbando, eventualmente, a proteostase celular, ou seja, as rotas biológicas que controlam a biogênese, enovelamento, tráfico e degradação das proteínas nas células. De fato, em condições de altos fluxos de peroxinitrito, os autores demonstraram que o oxidante promove mais oxidação, nitração, inativação e agregação da PDI.
Fluorescência intrínseca
A PDI está localizada principalmente no retículo endoplasmático, em concentrações da ordem de milimolar, mas está também presente, em níveis muito menores, na superfície celular, no citossol, na mitocôndria e na matriz extracelular.
Como explica a pesquisadora, as várias funções da PDI resultam de sua estrutura característica. “Ela é constituída por 508 resíduos de aminoácidos organizados como uma estrutura em forma de U que possui domínios sequenciais nomeados –a–b–b’–a’–c. Os domínios a e a’ nos braços do “U” contêm um motivo redox ativo CGHC (cisteina, glicina, histidina, cisteina) cada, enquanto os domínios b e b’ na parte inferior do “U” são ricos em resíduos hidrofóbicos envolvidos no reconhecimento e ligação da proteína substrato (a PDI atua sobre outras proteínas). Os domínios a e a’ contendo os motivos CGHC são responsáveis pela regulação da capacidade das cisteínas dos sítios ativos de oxidar, reduzir e isomerisar ligações dissulfeto de proteínas substratos”.
E é ao catalisar essas reações de oxidação, redução e isomerização das ligações dissulfeto que a PDI participa ativamente do enovelamento correto de proteínas. A enzima possui também uma atividade chaperona aparentemente independente de suas cisteínas reativas, permitindo que ela enovele proteínas que não contenham grupos tióis.
Por isso, o grupo de Ohara Augusto resolveu estudar detalhadamente a cinética e os produtos da oxidação da PDI por peroxinitrito, em colaboração com o grupo de Francisco Laurindo, do InCor USP e do CEPID Redoxoma, o qual tem dado enormes contribuições para elucidar as funções sinalizadoras da PDI.
Segundo Augusto, a escolha do peroxinitrito como oxidante da PDI foi baseada em fatos já comprovados na literatura. “Primeiro, o peroxinitrito, um oxidante potente produzido pela rápida reação do ânion radical superóxido com óxido nítrico, é o principal promotor não enzimático da nitração de proteínas e da oxidação de cisteínas proteicas em condições fisiológicas. Segundo, o peroxinitrito já foi implicado em estresse do retículo endoplasmático. Terceiro, em outros compartimentos celulares, como demonstrado anteriormente pelo Laurindo, a PDI interage e regula a enzima NADPH oxidase, produtora do ânion superóxido, aumentando as possibilidades da PDI reagir com peroxinitrito.”
Para realizar o estudo, foi necessário primeiro demonstrar que medir o decréscimo da fluorescência intrínseca da PDI quando ocorria a oxidação das cisteínas do sítio ativo seria adequado para estudos cinéticos. Para isso, o grupo determinou a constante de velocidade da oxidação dos resíduos cisteína redox-ativos da PDI (Cys53 e Cys397) por peróxido de hidrogênio (k = 17,3 M-1 s-1). Esse valor foi consistente com um valor reportado anteriormente na literatura para um mutante do domínio a da PDI (9,2 M-1 s-1) contendo só um sítio ativo e, portanto, o método poderia ser utilizado com peroxinitrito. A reação dos resíduos cisteína redox-ativos da PDI com peroxinitrito foi consideravelmente mais rápida (k = 6,9 × 104 M-1 s-1), e ambos os resíduos de cisteína foram cineticamente indistinguíveis.
Em seguida, proteólise limitada, simulações cinéticas e análises de espectrometria de massas confirmaram que o peroxinitrito oxida preferencialmente os resíduos de cisteína redox-ativos da PDI (C53 e C397) para os ácidos sulfênicos correspondentes, que reagem com as cisteínas de resolução próximas (C56 e C400) para produzir dissulfetos (isto é, Cys53-Cys56 e Cys397–Cys400 ). Uma fração do peroxinitrito, no entanto, decaia em radicais que hidroxilaram e nitraram outros resíduos do sítio ativo (Trp52, Trp396 e Tyr393). Os experimentos também foram repetidos com a utilização de peroxinitrito em excesso em relação às cisteínas reativas da PDI e, nesse caso, os pesquisadores observaram a oxidação e nitração de mais resíduos da PDI, além de inativação e agregação da enzima.
PDIs modificadas já foram encontradas em culturas celulares desafiadas com doador de óxido nítrico, em amostras biológicas de pessoas com doenças neurodegenerativas, em amostras de fígados de ratos tratados com dieta rica em gordura e etanol, em áreas ricas em lipídeos de lesões ateroscleróticas humanas avançadas, em camundongos velhos, em biópsias musculares de pacientes com doenças mitocondriais e na medula espinhal de um modelo de camundongo de esclerose lateral amiotrófica.
O artigo Peroxynitrite preferentially oxidizes the dithiol redox motifs of protein disulfide isomerase, de Albert Souza Peixoto, R Ryan Geyer, Asif Iqbal, Daniela R Truzzi, Ana I. Soares Moretti, Francisco R. M. Laurindo e Ohara Augusto, pode ser lido por assinantes em http://www.jbc.org/content/293/4/1450.short
