Estudo desvenda mecanismos que controlam a dupla localização de enzimas antioxidantes nas mitocôndrias
Em artigo publicado esta semana no The Journal of Biological Chemistry (JBC), pesquisadores do CEPID Redoxoma liderados pelo professor Luis E.S. Netto, do Instituto de Biociências da USP (IB-USP), descreveram os mecanismos que controlam a localização de peroxirredoxinas em distintos compartimentos mitocondriais e apresentaram evidências diretas, pela primeira vez, de que as enzimas são encontradas em dois locais: na matriz e no espaço intermembrana mitocondrial. As peroxirredoxinas são as principais enzimas que removem peróxidos nas células e as mitocôndrias são importantes fontes de geração de peróxidos.
“As peroxirredoxinas estão relacionadas tanto com a atividade antioxidante quanto com a sinalização redox. Nesse trabalho mostramos como a peroxirredoxina 1 de levedura é importada para compartimentos mitocondriais distintos por sistemas diferentes. Também vimos que, no caso da importação para a matriz mitocondrial, o mesmo processamento ocorre com a peroxirredoxina 3 humana. Compreender tais mecanismos é importante porque sabemos que cada compartimento mitocondrial tem funções diferentes e a importação de proteínas para esses compartimentos deve ser regulada com precisão”, afirmou Luis Netto.
Além de produzir energia celular na forma de ATP, as mitocôndrias estão envolvidas na regulação de diversos processos. As duas membranas lipídicas que definem espacialmente a organela são necessárias para criar compartimentos com funções diversas. Por exemplo, processos como o ciclo de Krebs, a replicação do DNA mitocondrial (mtDNA) e a síntese proteica ocorrem na matriz, enquanto o ambiente mais oxidante do espaço intermembrana é apropriado para a formação de ligações dissulfeto.
Processos redox que ocorrem nos subcompartimentos mitocondriais geram espécies reativas de oxigênio que podem causar danos a macromoléculas, resultando em disfunção mitocondrial e, eventualmente, morte celular. A disfunção mitocondrial está associada a diversas doenças degenerativas e ao envelhecimento. Por outro lado, sabe-se também que essas espécies desempenham papéis como moléculas de sinalização em processos como imunidade, diferenciação e autofagia. Por isso, os níveis das espécies reativas são rigorosamente controlados e as peroxidases exercem um papel regulatório, diminuindo os níveis de peróxido de hidrogênio (H2O2) dentro das mitocôndrias.
Mecanismo conservado
Peroxirredoxinas (Prxs) são tiól-proteínas que catalisam a redução de peróxido de hidrogênio, hidroperóxidos orgânicos e peroxinitrito. As células de mamíferos expressam seis isoformas de Prx, cada uma codificada por um gene diferente. Em leveduras, existem cinco isoformas, das quais uma, a Prx1, localiza-se na mitocôndria e desempenha um importante papel na eliminação do peróxido de hidrogênio (H2O2) produzido a partir da cadeia de transporte de elétrons.
Com o objetivo de entender o papel funcional das peroxirredoxinas na manutenção da homeostase redox mitocondrial, os pesquisadores inicialmente investigaram a localização da Prx1 da levedura Saccharomyces cerevisiae nos diferentes compartimentos mitocondriais. Os estudos foram realizados por meio do subfracionamento mitocondrial seguido por análises de western-blot e os dados foram confirmados por análises de espectrometria de massas. Depois, a partir de linhagens mutantes de levedura, eles identificaram os mecanismos de importação que controlam a localização de Prx1 nos diferentes compartimentos mitocondriais.
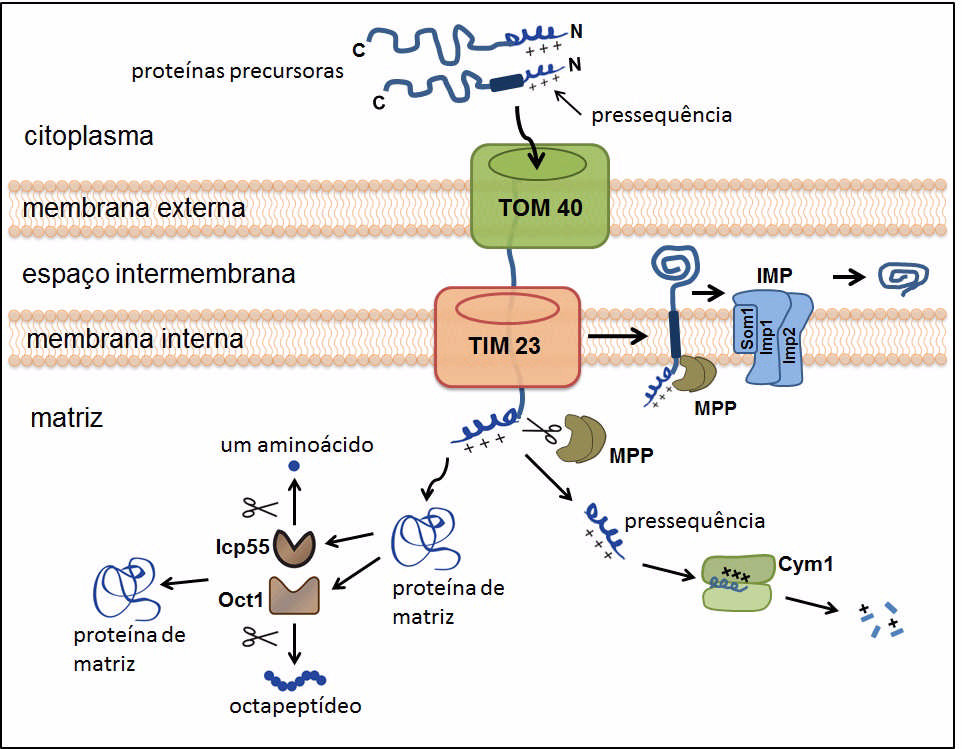
A maior parte das proteínas mitocondriais é codificada por genes nucleares, traduzida no citoplasma e posteriormente importada para o interior da organela. Para importar proteínas, as mitocôndrias contam com diversos complexos proteicos localizados nas membranas mitocondriais externa e interna. Dois destes complexos transportadores, um localizado na membrana externa, chamado TOM, (translocase of the outer membrane) e outro localizado na membrana interna, o TIM23 (presequence translocase of the inner membrane), reconhecem uma sequência específica de aminoácidos, conhecida como pressequência. A pressequência é uma extensão de aminoácidos localizada na região N-terminal, que sinaliza a importação da maioria das proteínas para a matriz mitocondrial. Durante a importação, as proteínas contendo a pressequência passam sequencialmente pelos complexos TOM e TIM23 e finalmente alcançam a matriz mitocondrial.
A Prx1 também faz esse caminho, mas, como descobriram os pesquisadores, a partir do complexo TIM23 há duas possibilidades: ela vai para a matriz ou para o espaço intermembrana, por mecanismos diferentes. O mecanismo de importação para o espaço intermembrana envolve a liberação da proteína precursora de Prx1 dentro da bicamada lipídica da membrana interna, seguido da clivagem da pressequência catalisada pela peptidase Imp2, que é uma subunidade catalítica do complexo IMP (inner membrane peptidase). No caso da importação para a matriz, após ser transportada pelo complexo TIM23, Prx1 é clivada pela peptidase de processamento mitocondrial (MPP), a qual remove a pressequencia e, em seguida, pela octapeptidil aminopeptidase 1 (Oct1). A Oct1 catalisa a clivagem de oito resíduos de aminoácidos da região N-terminal da Prx1 que foi inicialmente clivada por MPP. Esse segundo evento de clivagem não interfere com a atividade peroxidásica da proteína in vitro. O papel funcional da clivagem de Oct1 permanece desconhecido, apesar de estudos apontarem que aumenta a estabilidades das proteínas no interior da matriz.
Com base nos dados obtidos, os autores do artigo sugerem que as proteases Imp2 e MPP/Oct1 são sistemas que controlam a localização das peroxirredoxinas em compartimentos mitocondriais distintos, contribuindo para vários processos redox que ocorrem nas mitocôndrias.
Outro resultado importante do trabalho foi a constatação de que o processamento das peroxirredoxinas mitocondriais pela protease Oct1 manteve-se altamente conservado durante a evolução. Para comprovar isso, os pesquisadores expressaram a Prx3 humana na levedura e constataram que ela é igualmente clivada pela Oct1. Analisando a sequencia de aminoácidos da região N-terminal da Prx3 de vários mamíferos, com os locais de possíveis sítios de clivagem pelas proteases MPP e Oct1, eles observaram que os aminoácidos são praticamente idênticos.
Doenças
Tanto a Oct1 quanto a Imp2 têm proteínas homólogas em humanos e mutações nos genes que codificam essas peptidases estão associadas a doenças. No caso da Oct1, a relação seria com a Yfh1, cuja proteína homologa em humanos é a frataxina, proteína mitocondrial implicada na ataxia de Friedreich, que é uma doença neurodegenerativa hereditária. Já mutações na IMMP2L, homóloga da Imp2, foi implicada na patogênese da síndrome de Tourette, que é um distúrbio neuropsiquiátrico.
Segundo Netto, em células de levedura mutantes, nas quais falta o gene que codifica a Oct1, ocorre perda do DNA mitocondrial e da capacidade respiratória.
O pesquisador ressalta, no entanto, que os mecanismos moleculares envolvidos na disfunção mitocondrial em decorrência da ausência das proteases Oct1 e Imp2 permanecem pouco estudados. Possivelmente, o direcionamento das peroxirredoxinas para diferentes compartimentos mitocondriais desempenha um importante papel na manutenção da função mitocondrial.
Os estudos apresentados neste trabalho foram realizados durante o doutorado de Fernando Gomes, primeiro autor do artigo, sob supervisão de Luis Netto, e contou com a participação de Mario H. Barros, do ICB-USP, e Marilene Demasi, do Instituto Butantan, ambos pesquisadores do CEPID Redoxoma. Além disso, o grupo contou com a infraestrutura do Redoxoma para as análises por espectrometria de massas.
O artigo Proteolytic cleavage by the IMP complex or Oct1 peptidase controls the localization of the yeast peroxiredoxin Prx1 to distinct mitochondrial compartments, de Fernando Gomes, Flávio Romero Palma, Mario H. Barros, Eduardo T. Tsuchida, Helena G. Turano, Thiago G. P. Alegria, Marilene Demasi e Luis E. S. Netto, pode ser lido por assinantes aqui.
