Estudo comprova papel central da enzima Ohr na defesa antioxidante de bactérias
Em artigo publicado na revista Proceedings of the National Academy of Sciences USA (PNAS), o grupo do professor Luis Eduardo Soares Netto, do Instituto de Biociências da USP e membro do CEPID Redoxoma, mostrou que a enzima Ohr (Organic hydroperoxide resistance protein) desempenha papel central na resposta bacteriana a hidroperóxidos de ácidos graxos e a peroxinitrito, dois oxidantes que atuam durante interações hospedeiro-patógeno. A Ohr é uma enzima antioxidante presente principalmente em bactérias e micro-organismos, alguns deles patogênicos tanto para animais, incluindo os seres humanos, quanto para plantas.
Hidroperóxidos estão envolvidos na sinalização celular, entre outros processos. Por exemplo, os hidroperóxidos do ácido araquidônico e do ácido linoleico são mediadores de processos inflamatórios em mamíferos e em plantas, respectivamente. O peroxinitrito também é produzido pelo hospedeiro (planta ou animal) em resposta à infecção pelo patógeno. “Como a Ohr reduz hidroperóxidos e peroxinitrito a produtos menos tóxicos com extrema eficiência, podemos supor que a proteína poderia impactar a progressão da resposta imune, ou seja, de alguma forma parece que esta enzima está subvertendo a resposta inflamatória”, afirmou Netto.
Com diferentes abordagens experimentais, os pesquisadores investigaram o envolvimento da Ohr na resposta bacteriana a diversos hidroperóxidos. Inicialmente, mostraram que a Ohr da Xylella fastidiosa (XfOhr) reduzia preferencialmente hidroperóxidos de ácidos graxos de cadeia longa e peroxinitrito. Depois, realizaram ensaios microbiológicos utilizando a bactéria Pseudomonas aeruginosa como modelo e obtiveram resultados consistentes com os que haviam sido obtidos nos ensaios bioquímicos e cinéticos e em simulações computacionais. Os estudos foram parte da dissertação de mestrado de Thiago Alegria, parte da tese de doutorado de José Renato Cussiol e do programa de pós-doutoramento de Diogo Meireles. Também contaram com a colaboração de vários pesquisadores principais da rede Redoxoma.
Eficiência
As relações entre patógenos e hospedeiros são complexas e foram moduladas durante o processo evolutivo. Dentre vários mecanismos, plantas e animais disparam uma resposta inflamatória, com geração de oxidantes, dentre os quais os hidroperóxidos derivados de ácidos graxos. E as bactérias, como resposta à exposição a esses oxidantes, desenvolveram mecanismos antioxidantes.
A Ohr é uma proteína que faz parte do sistema de defesa antioxidante de bactérias e foi inicialmente descrita em 1998. Desde então, vem sendo estudada por Luis Netto, como desdobramento de informações obtidas a partir do sequenciamento do genoma da Xylella fastidiosa, bactéria causadora da doença clorose variegada dos citros (CVC) ou “amarelinho”, do qual o pesquisador fez parte.
Netto e seu grupo conseguiram obter a proteína XfOhr pura em grandes quantidades, utilizando técnicas da biologia molecular, com o objetivo de testar a hipótese de que a proteína seria capaz de decompor peróxidos devido à presença de cisteínas altamente reativas em seu sítio ativo. Eles desvendaram a estrutura da proteína XfOhr e comprovaram a hipótese de que o microambiente onde as cisteínas se encontram confere a elas alta reatividade. Após serem oxidadas por hidroperóxidos orgânicos, essas enzimas são reduzidas por compostos tiólicos (que apresentam o grupo –SH).
“Anteriormente, já tínhamos identificado que proteínas lipoiladas eram o provável substrato redutor de Ohr. Agora, neste trabalho, identificamos o substrato oxidante. No caso, os hidroperóxidos de ácidos graxos e o peroxinitrito”, explicou Netto.
Na atual pesquisa, inicialmente foram realizadas análises por docking (ancoragem) molecular in silico e os resultados dessas simulações mostraram o encaixe do substrato no sítio ativo da proteína, apontando para uma grande complementariedade estrutural entre a Ohr e os hidroperóxidos de ácidos graxos.
A proteína pura, ou seja, fora do ambiente celular, foi, então, testada com diferentes hidroperóxidos e as velocidades de reação foram medidas por vários ensaios. Como não existem muitas ferramentas para o estudo dos hidroperóxidos orgânicos, os pesquisadores desenvolveram um novo método para determinar as constantes de velocidade das reações entre a XfOhr e hidroperóxidos.
A XfOhr não é fluorescente, por não possuir o resíduo triptofano. Já uma outra proteína chamada de AhpE, que é uma peroxirredoxina encontrada em Mycobacterium tuberculosis, além de apresentar um ótimo sinal relacionado a fluorescência intrínseca do resíduo de triptofano, tem sua intensidade alterada de acordo com seu estado de oxidação. Além disso, AhpE reage rapidamente com os hidroperóxidos de ácidos graxos e peroxinitrito e tem as respectivas constantes de velocidade determinadas. Desta forma, foi possível desenvolver um ensaio de competição entre a Ohr e a AhpE por hidroperóxidos com diferentes estruturas químicas. Esse método foi desenvolvido em colaboração com pesquisadores do Center for Free Radical and Biomedical Research, do Uruguai. Com a nova ferramenta, as constantes de velocidade das reações entre Ohr e vários hidroperóxidos de ácidos graxos foram determinadas e são da ordem de 107 a 108 M-1s-1. Também a constante de redução do peroxinitrito pela Ohr foi obtida e é da ordem de 107 M-1s-1, em pH 7,4.
A título de comparação, a albumina, que é uma proteína que também possui resíduos de cisteína e, portanto, pode ser usada como um normalizador, reage com o peroxinitrito e com hidroperóxidos de ácidos graxos com constantes de velocidade da ordem de 103 M-1s-1 e 101 M-1s-1, respectivamente. No primeiro caso, a Ohr reage 10 mil vezes mais rápido que a albumina e no segundo, 10 milhões de vezes mais rapidamente. Portanto, o ganho catalítico produzido pela Ohr é enorme.
“Por suas características físico-químicas, é surpreendente que a Ohr seja tão reativa com o peroxinitrito”, observou o pesquisador. O peroxinitrito é bastante solúvel em água, enquanto o sítio ativo da Ohr é muito hidrofóbico. Por outro lado, o peroxinitrito é um forte oxidante quando comparado com outros hidroperóxidos. Além disso, ele se decompõe rapidamente em pH fisiológico, gerando produtos que podem matar a bactéria. Ao reagir antes com a Ohr, o peroxinitrito é reduzido a produtos menos tóxicos (nitrito e água), o que previne danos a outras biomoléculas importantes da célula, como DNA, proteínas e lipídeos.
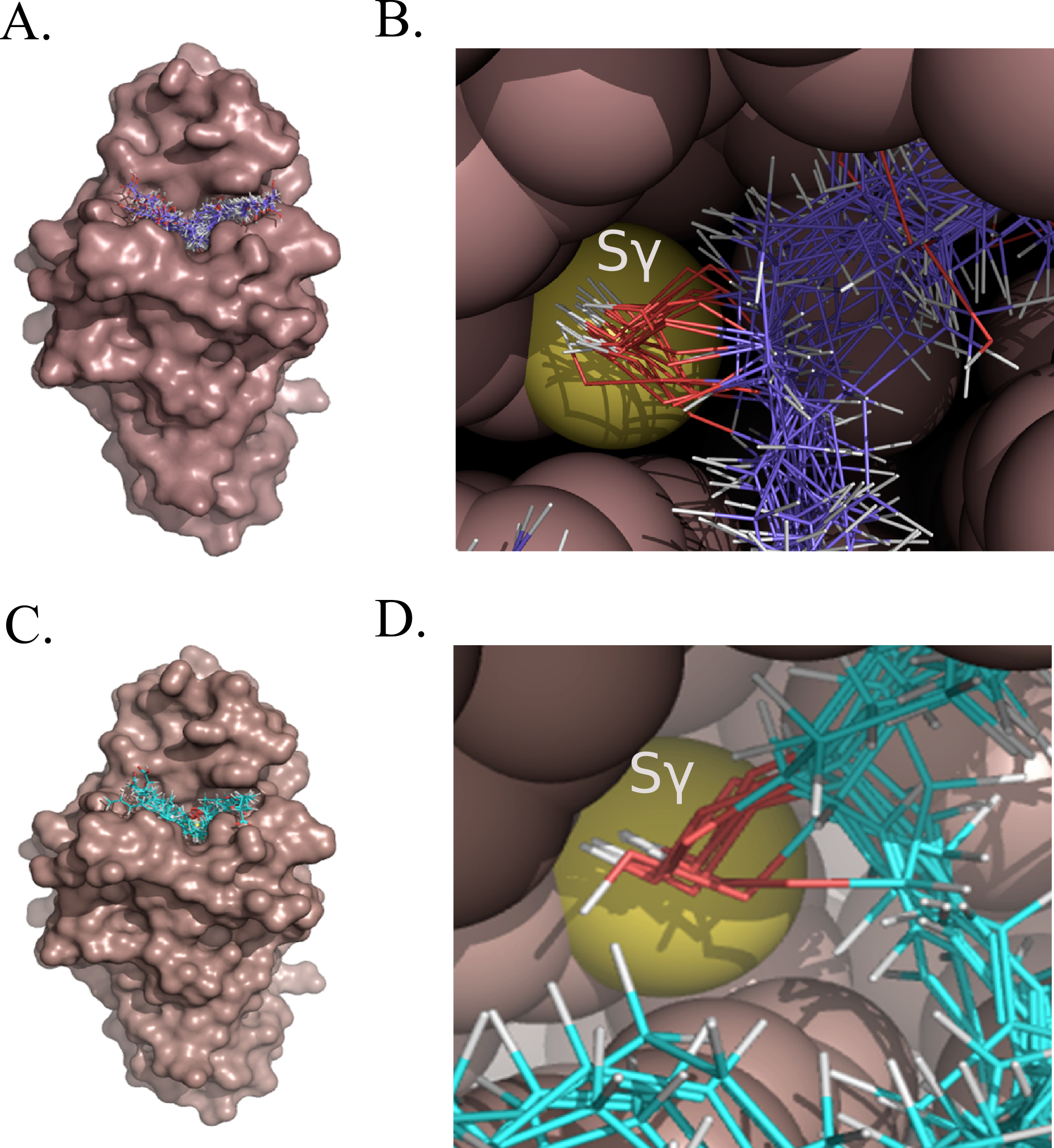
Docking molecular de hidroperóxidos de cadeia longa no sítio ativo da Ohr [ Figura: Thiago G. P. Alegria, et al. Ohr plays a central role in bacterial responses against fatty acid hydroperoxides and peroxynitrite. Proceedings of the National Academy of Sciences Online, www.pnas.org, Jan 10, 2017, vol. 114 no. 2 , E132–E141 (doi: 10.1073/pnas.1619659114) ]
Ensaios microbiológicos
O passo seguinte foi investigar qual seria a sensibilidade de bactérias sem Ohr aos tratamentos com vários hidroperóxidos, considerando que o ambiente celular é muito mais complexo que o sistema enzimático, apresentado vias que podem competir entre si.
Para realizar esses estudos, os pesquisadores utilizaram a linhagem mutante chamada ΔOhr, na qual o gene da Ohr foi removido da bactéria Pseudomonas aeruginosa. Posteriormente, compararam a sensibilidade a hidroperóxidos das bactérias selvagens (wild type), que têm o gene da Ohr, com bactérias da linhagem ΔOhr, que não têm o referido gene.
A comparação foi feita com um ensaio de viabilidade chamado Minimal Inhibitory Concentration (MIC), no qual as bactérias são colocadas em placas e submetidas a várias concentrações de diferentes hidroperóxidos. Os resultados foram observados após 16 horas e mostraram que a linhagem selvagem resiste a altas concentrações de hidroperóxidos de ácidos graxos, enquanto a linhagem mutante (ΔOhr) não cresce mesmo com as menores doses utilizadas.
Quando o gene da Ohr foi novamente inserido na linhagem ΔOhr, essas bactérias transformadas geneticamente voltaram a adquirir resistência aos hidroperóxidos. Para o pesquisador, “esse é um controle importante e é interessante do ponto de vista genético, pois o processo de geração de bactérias mutantes pode afetar outros genes”.
Outro aspecto interessante, segundo Netto, é que bactérias têm um grande repertório de proteínas antioxidantes, incluindo peroxirredoxinas e catalases. Por isso eles também testaram a sensibilidade de mutantes nas principais enzimas envolvidas com detoxificação de hidroperóxidos. Todavia, somente a linhagem Δohr apresentou alta sensibilidade aos desafios por hidroperóxidos de ácidos graxos e peroxinitrito. Segundo o pesquisador, esses dados indicaram que Ohr tem papel central na resposta de bactérias ao estresse induzido por esses oxidantes.
O pesquisador ressaltou que os resultados obtidos no estudo mostram uma consistência interna dos dados muito grande. A importância da enzima Ohr para a resposta da bactéria contra hidroperóxidos de ácidos graxos e peroxinitrito foi demonstrada a partir de diferentes abordagens, por ensaios independentes e com níveis de complexidade diversos. “O que nossos dados levam a especular é que a Ohr foi selecionada ao longo da evolução para reduzir peróxidos de ácidos graxos e, como um efeito colateral, ela também reduz com muita eficiência o peroxinitrito”, concluiu.
Por ser uma enzima majoritariamente presente em bactérias e ausente em organismos como humanos e plantas superiores, este estudo pode estimular o desenvolvimento de inibidores da Ohr como alvo para tratamento de infecções bacterianas.
O artigo Ohr plays a central role in bacterial responses again fatty acid hydroperoxides and peroxynitrite, de Thiago G.P. Alegria, Diogo de A. Meireles, José R. R. Cussiol, Martin Hugo, Madia Trujillo, Marcos Antonio de Oliveira, Sayuri Miyamoto, Raphael F. Queiroz, Napoleão Fonseca Valadares, Richard C. Garrattf, Rafael Radi, Paolo Di Mascio, Ohara Augusto e Luis E. S. Netto, pode ser lido em http://www.pnas.org/content/114/2/E132
