Estudo caracteriza mecanismo de hiperinflamação e propõe novo alvo terapêutico para tratamento de sepse
Pessoas que sofrem de doença granulomatosa crônica (DGC), além de uma propensão maior a infecções graves e repetidas, apresentam um quadro hiperinflamatório. A DGC ocorre quando os neutrófilos têm uma deficiência no complexo enzimático nicotinamida adenina dinucleotídeo fosfato oxidase 2 (Nox2). A hiperinflamação em resposta à invasão de micro-organismos também está associada à sepse, que, quando exacerbada, leva à falência múltipla de órgãos e à morte.
Em artigo publicado na revista Scientific Reports, do grupo Nature, pesquisadores propuseram um mecanismo que explica a regulação do estado redox da tiorredoxina-1 (Trx-1) pela Nox2 de leucócitos e avaliaram como as mudanças na Trx-1 regulam o fator de transcrição NF-κB na doença granulomatosa crônica e em sepse.
“A deficiência de Nox2 ou sua inibição com apocinina (APO) resulta em um estresse redutor, provocando o acúmulo de tiorredoxina-1 no núcleo celular e o aumento da transcrição de citocinas pró-inflamatórias por meio da ativação do NF-κB”, explicou a professora Lucia Lopes, uma das autoras correspondentes do artigo.
Além disso, os pesquisadores mostraram que a superativação do NF-κB pode ser impedida com a inibição da tiorredoxina redutase-1, enzima responsável pela redução da tiorredoxina-1. Quando reduzida, a proteína migra para o núcleo e aumenta a associação do NF-κB ao DNA. Os resultados obtidos sugerem que a tiorredoxina redutase pode ser um novo alvo terapêutico no tratamento da sepse.
O estudo é parte da tese de doutorado de Silvia Cellone Trevelin e foi realizado pelos grupos da professora Lucia Rossetti Lopes, do Instituto de Ciências Biomédicas da Universidade de São Paulo e membro do CEPID em Processos Redox em Biomedicina — Redoxoma, e do professor Fernando Queiroz Cunha, da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo e diretor do CEPID em Doenças Inflamatórias (CRID).
Mecanismo
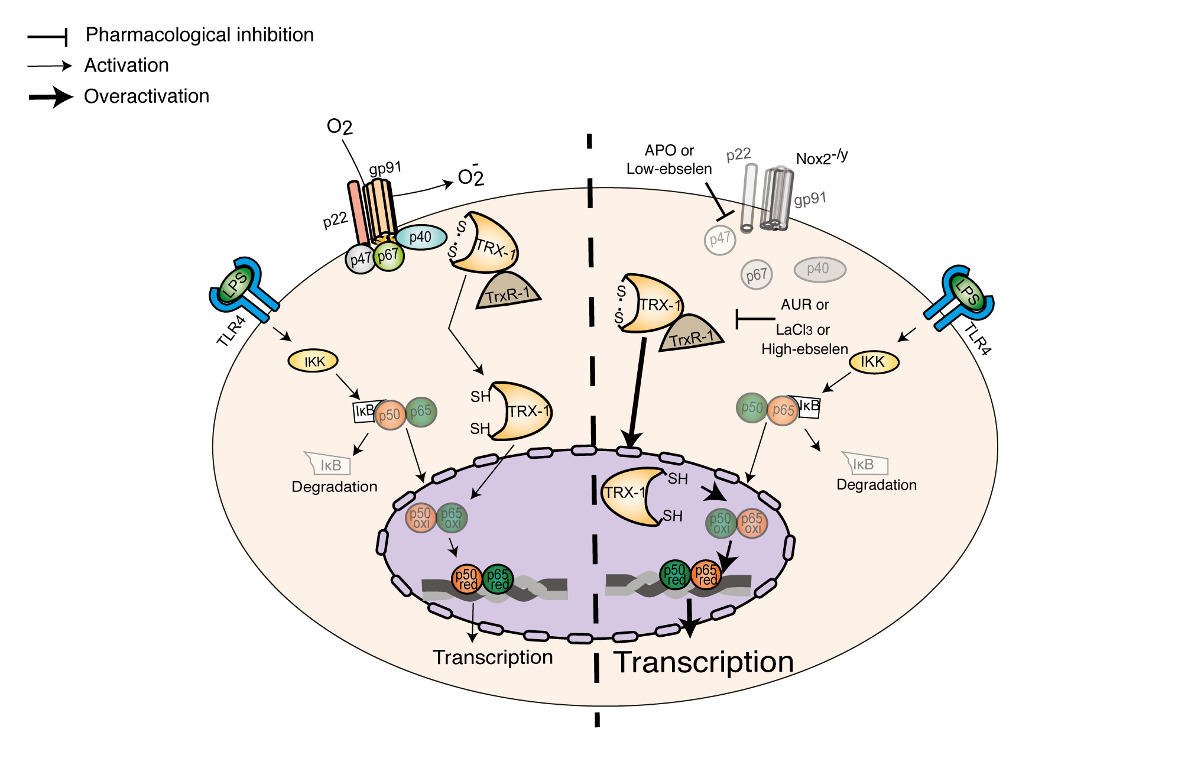
O sistema NADPH oxidase (Nox) é um complexo enzimático gerador de superóxido, que tem um papel chave no controle de infecções. Para entender como a Nox2 regula a inflamação, os pesquisadores submeteram camundongos nocaute para Nox2 e wild type ao modelo de sepse induzida por cecal ligation and puncture (CLP). Num primeiro momento, observaram que os animais nocaute para Nox2 morriam mais do que os outros, o que era de se esperar, na medida em que Nox2 é principalmente microbicida.
Os dois grupos de animais foram, então, tratados com antibióticos e apresentaram melhora do quadro infeccioso. No entanto, os animais nocaute para Nox2 continuaram morrendo mais e tiveram aumento da resposta inflamatória sistêmica e da disfunção múltipla de órgãos. Investigações mostraram que os animais sépticos tinham uma resposta inflamatória exacerbada, decorrente da hiperativação do fator nuclear de transcrição NF-κB.
O NF-κB é um fator de transcrição que leva à expressão de várias proteínas de defesa, sendo um marcador de inflamação. Sempre que ele é ativado ocorre uma resposta inflamatória.
Para estabelecer possíveis relações entre a Nox2 e a ativação do NF-κB, os pesquisadores usaram a apocinina, que é um inibidor da Nox2, em macrófagos de animais wild type e o efeito visto foi um aumento na produção de citocinas e na ativação do NF-κB. Como a apocinina não inibiu a migração do NF-κB do citosol para o núcleo, o efeito da Nox2 na ativação do fator de transcrição deveria ser relacionado a sua ligação ao DNA.
E aí entra a tiorredoxina.
O sistema tiorredoxina é composto pela tiorredoxina redutase, pela tiorredoxina e pelo NADPH que é o substrato da tioredoxina redutase. Este sistema é responsável pela regulação de vários processos bioquímicos na célula, com um papel importante na manutenção do ambiente redox celular.
Após estímulo inflamatório por lipopolissacarídeo (LPS), o superóxido produzido pela Nox2 oxida a Trx-1 — que se associa à p40phox, uma subunidade reguladora da Nox2 —, mantendo-a no citosol. Em células deficientes em Nox2 ocorre um estresse redutor, com aumento da glutationa reduzida e de outros grupos tióis livres. Isso leva a uma redução da Trx-1 e à migração e acúmulo desta tiol redutase no núcleo celular.
Níveis mais elevados de Trx-1 no núcleo modulam diretamente a atividade do NF-κB, por meio da redução de seus resíduos de cisteína. Com isso, há um aumento da associação do NF-κB ao DNA, implicando maior transcrição de citocinas pró-inflamatórias.
A importância da via de sinalização intracelular envolvendo Nox2/Trx-1/NF-κB foi confirmada em leucócitos de pessoas saudáveis e de pacientes com doença granulomatosa crônica.
Os pesquisadores constataram que uma maneira de impedir o acúmulo de tiorrredoxina-1 no núcleo é inibir a ação da tiorredoxina redutase.
Ao tratarem camundongos sépticos com cloreto de lantânio ou com auranofina, dois inibidores da tiorredoxina redutase, eles verificaram que a sobrevida dos animais passou de 22 para 67%.
“Inibir a tiorredoxina redutase em pacientes não é trivial, por isso é preciso muita cautela. Mas nossos resultados indicam que a tiorredoxina redutase pode ser um novo alvo terapêutico no tratamento da sepse”, afirmou Lopes.
O artigo Apocynin and Nox2 regulate NF-κB by modifying thioredoxin-1 redox state, de Silvia Cellone Trevelin, Célio Xavier dos Santos, Raphael Gomes Ferreira, Larissa de Sá Lima, Rangel Leal Silva, Cristoforo Scavone, Rui Curi, José Carlos Alves-Filho, Thiago Mattar Cunha, Pérsio Roxo-Júnior, Maria-Célia Cervi, Francisco Rafael Martins Laurindo, John Stephen Hothersall, Andrew M. Cobb, Min Zhang, Aleksandar Ivetic, Ajay M. Shah, Lucia Rossetti Lopes e Fernando Queiroz Cunha, pode ser lido em http://www.nature.com/articles/srep34581
