Estudo revela mecanismo da modulação estrutural de peroxirredoxinas, os sensores celulares de peróxidos
Em artigo publicado esta semana na revista Scientific Reports, do grupo Nature, pesquisadores do CEPID Redoxoma propõem um mecanismo para explicar como um resíduo conservado de treonina catalítica modula a estrutura quaternária das peroxirredoxinas, enzimas antioxidantes que têm um papel importante na sinalização redox e estão envolvidas em processos como câncer, neurodegeneração e interações patógeno-hospedeiro.
“Nosso trabalho é pesquisa básica e representa uma forma de conhecer melhor como funciona um sensor de peróxido nas células. Obtivemos informações que relacionam dois fenômenos que eram descritos para peroxirredoxinas, mas que estavam desconexos: a questão da estabilidade estrutural, com a alteração entre decâmero e dímero, e a questão de como isso era modulado de forma redox. Nossos dados mostram que o resíduo de treonina catalítica parece ser a conexão entre essas duas facetas”, afirmou Luis Netto, um dos coordenadores da pesquisa.
O estudo foi realizado pelos grupos dos professores Luis E. S. Netto, do Instituto de Biociências da Universidade de São Paulo, e Marcos A. de Oliveira, do Instituto de Biociências da Universidade Estadual Paulista, respectivamente membro do comitê gestor e colaborador do CEPID Redoxoma. Este trabalho foi parte da tese de doutorado de Carlos A. Tairum Jr. e do projeto de iniciação científica da aluna Melina Cardoso dos Santos, além de contar com o apoio de outros grupos do Redoxoma.
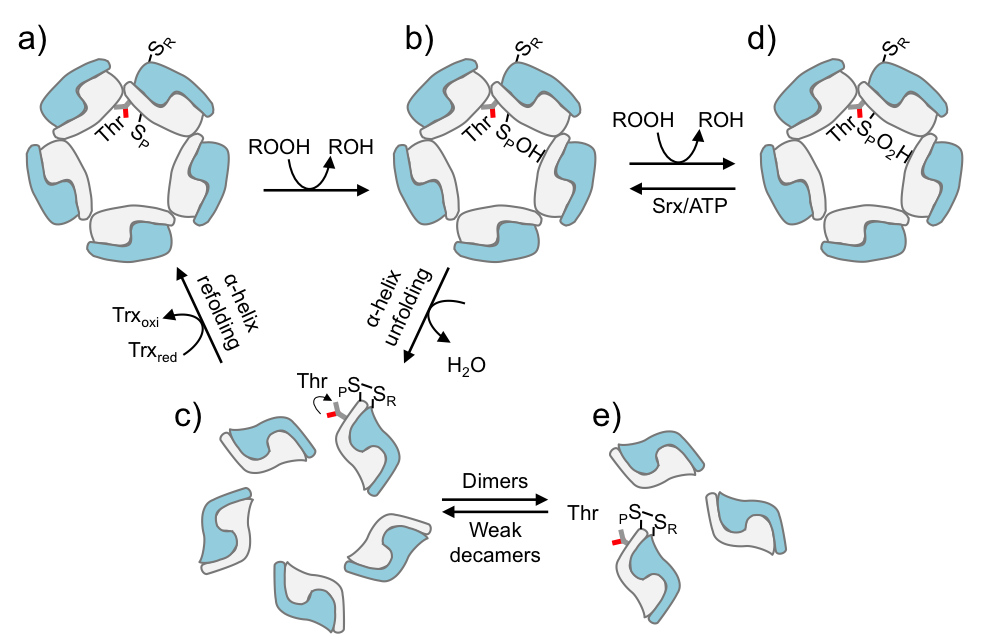 Mecanismo proposto para a redução de hidroperóxido por 2-Cys Prx.
Mecanismo proposto para a redução de hidroperóxido por 2-Cys Prx.Dímeros e decâmeros
Peroxirredoxinas (Prx) são tiól-proteínas que catalisam a redução de peróxido de hidrogênio, hidroperóxidos orgânicos e peroxinitrito. As células de mamíferos expressam seis isoformas de Prx (de I a VI), classificadas em três subgrupos (2-Cys, 2-Cys atípica e 1-Cys), com base no número e posição dos resíduos de cisteína que participam da catálise.
O presente trabalho aborda especificamente as 2-Cys Prxs que, devido às suas propriedades catalíticas, são consideradas sensores de peróxido de hidrogênio (H2O2), um oxidante relacionado com processos de sinalização celular. A regulação fina dos níveis de H2O2 por 2-Cys Prx estaria, portanto, relacionada com processos tais como supressão de tumores, diferenciação neuronal e doenças cardiovasculares.
As 2-Cys Prxs são capazes de reduzir hidroperóxidos com alta eficiência e especificidade, sendo que a reatividade da cisteína no ambiente do sítio ativo é de uma a dez milhões de vezes mais rápida do que a da cisteína livre do ambiente proteico. Isso se deve a um sítio ativo composto por uma tríade catalítica contendo uma cisteína peroxidásica, uma arginina e uma treonina (ou serina, em algumas espécies).
A cisteína peroxidásica (CP) é um resíduo de cisteína altamente conservado, usado pelas 2-Cys Prx para a redução dos hidroperóxidos, resultando na formação de um ácido sulfênico (CP-SOH). Durante o ciclo catalítico, um segundo resíduo de cisteína, a chamada cisteína de resolução (CR), reage com a CP-SOH do monômero adjacente para formar uma ligação dissulfeto intermolecular (entre dois polipeptídeos distintos). As 2-Cys Prxs são homodímeros que podem se associar em decâmeros, ou seja, pentâmeros de dímeros.
Segundo os autores, uma característica interessante das 2-Cys Prxs é sua capacidade de alternar entre estruturas quaternárias distintas: durante a catálise, elas fazem transições reversíveis entre decâmeros e dímeros. E essas transições dependem do estado de oxidação da cisteína.
Para entender o mecanismo envolvido nessa modulação, eles compararam as estruturas de diversas 2-Cys Prxs. Com base nos dados cromatográficos e estruturais obtidos, concluíram que a treonina catalítica localizada na interface entre dois dímeros funciona como uma espécie de interruptor. Quando a proteína é oxidada, ela sofre uma mudança conformacional e a treonina passa a ocupar o espaço de outros aminoácidos, desestabilizando a estrutura decamérica da enzima. “Esse movimento da treonina ocorre quando a Prx vai de reduzida para oxidada”, explicou Netto, acrescentando que, provavelmente, a desestabilização do decâmero ocorre por impedimento estérico, ou seja, por uma questão espacial. As variantes da proteína que possuem uma serina no sítio ativo são sempre decaméricas. A serina é um aminoácido menor do que a treonina e, por isso, teria mais espaço para se movimentar.
Com base em dados cinéticos obtidos com o apoio dos grupos de pesquisa dos professores Ohara Augusto e José Toledo Jr., membros do Redoxoma, os pesquisadores também constataram que, como uma tendência geral, mutações que estabilizam a proteína na forma decamérica têm uma atividade catalítica maior do que as que são estabilizadas na forma dimérica.
Diversas técnicas foram utilizadas na análise das estruturas e das reatividades das 2-Cys Prxs e, segundo os autores, a estrutura da rede Redoxoma foi muito importante nesse sentido. Para obter as proteínas em grande quantidade, os pesquisadores expressaram genes de peroxirredoxinas de levedura (Tsa1 e Tsa2) em bactéria E. Coli e depois purificaram as proteínas produzidas. Utilizando métodos de biologia molecular, foram geradas mutações de amino ácidos em Tsa1 como forma de testar as hipóteses propostas.
Peroxirredoxinas e sinalização redox
Um dado interessante em relação às peroxirredoxinas é que a sequência de aminoácidos de sua tríade catalítica (treonina, CP e arginina) é altamente conservada, sendo praticamente igual em todos os seres vivos, de bactérias a humanos. Em alguns casos, a treonina da tríade catalítica é substituída por uma serina, que também apresenta um grupo hidroxila na cadeia lateral. E em todas as Prx a CP está na mesma posição.
Os papéis fisiológicos dessas enzimas e os mecanismos pelos quais elas atuam, no entanto, ainda não foram totalmente esclarecidos.
As peroxirredoxinas são muito abundantes e reagem rapidamente com peróxidos, por isso são consideradas sensores de peróxidos nas células e teriam um papel central na sinalização redox, ao interagir com proteínas envolvidas claramente em sinalização celular, como quinases e fatores de transcrição.
Luis Netto exemplifica essa atividade com um dos modelos de sinalização propostos, de acordo com o qual o peróxido de hidrogênio reage com a CP , que é oxidada e em seguida oxida um fator de transcrição específico. Dessa forma, a peroxirredoxina media a oxidação do fator de transcrição, transmitindo o sinal que recebeu do peróxido de forma específica, por meio de uma interação física proteína-proteína.
Quando essas vias de sinalização são interrompidas, podem ser iniciados processos patológicos, como câncer, doenças neurodegenerativas e morte celular.
O pesquisador explica que células são ambientes confinados e congestionados, com milhares de proteínas e compostos de baixo peso molecular. Por isso, além das observações biológicas, são necessários dados químicos para que se possam fazer inferências sobre o que acontece nas células.
O artigo Catalytic Thr or Ser Residue Modulates Structural Switches in 2-Cys Peroxiredoxin by Distinct Mechanisms, de Carlos A. Tairum, Melina Cardoso Santos, Carlos A. Breyer, R. Ryan Geyer, Cecilia J. Nieves, Stephanie Portillo-Ledesma, Gerardo Ferrer-Sueta, José Carlos Toledo Jr., Marcos H. Toyama, Ohara Augusto, Luis E. S. Netto e Marcos A. de Oliveira, pode ser lido em http://www.nature.com/articles/srep33133
