Pesquisadores propõem novo mecanismo de remodelamento vascular
Em artigo publicado na revista Hypertension, da American Heart Association, o professor Francisco R.M. Laurindo, do Instituto do Coração da Faculdade de Medicina da USP e membro do CEPID Redoxoma, e seu grupo propõem que, em processos de reparo de lesão vascular, a proteína dissulfeto isomerase peri/epicelular (pecPDI) regula a arquitetura vascular, preservando o calibre do lúmen ao antagonizar o remodelamento constritivo.
“Nosso estudo mostrou que a pecPDI regula a arquitetura da matriz extracelular e do citoesqueleto da célula. O efeito que vimos não é uma mudança vasomotora, é estrutural, altera a matriz do colágeno e isso é típico do remodelamento. Esse é um mecanismo impactante de estreitamento de vasos, que pode ajudar a entender o mecanismo de doenças”, afirmou Laurindo.
O remodelamento vascular envolve mudanças na circunferência dos vasos sanguíneos e é um determinante fundamental do calibre vascular em situações tanto fisiológicas quanto patológicas, como em reestenose pós-angioplastia, aterosclerose nativa e shear stress. Ele pode ser constritivo (negativo) ou expansivo (positivo).
Embora seja um fenômeno reconhecido há muito tempo e esteja implicado na perda do calibre vascular em várias doenças, o mecanismo molecular do remodelamento vascular ainda é pouco conhecido.
Tecidos lesados cicatrizam por constrição, mas, no caso dos vasos sanguíneos, a constrição poderia levar a um estreitamento indesejável. “Podemos sugerir que, evolutivamente, a natureza aprendeu a cicatrizar vasos mantendo-os abertos e esse mecanismo é em parte operado pela pecPDI”, explicou o pesquisador.
A proteína dissulfeto isomerase (PDI) é uma chaperona do retículo endoplasmático (RE) pertencente à superfamília da tiorredoxina, com importante atividade na sinalização e homeostase redox e cuja função mais conhecida é o enovelamento de proteínas nascentes no RE.
Cerca de 98% da proteína se encontra no retículo e 2% no meio extracelular. Como a PDI extracelular tanto pode estar na superfície celular (epicelular) quanto pode ser secretada (pericelular), os pesquisadores propuseram a denominação PDI peri/epicelular (pecPDI).
Analisando artérias de pessoas que morreram de infarto agudo do miocárdio, os pesquisadores observaram que, em ateromas coronarianos humanos, a expressão da PDI está inversamente correlacionada com o remodelamento constritivo e a estabilidade da placa. Ou seja, em artérias com placas de aterosclerose apresentando remodelamento constritivo (negativo) foi detectada uma expressão diminuída da proteína e em artérias com remodelamento expansivo (positivo) a expressão estava aumentada.
In vivo, em artérias ilíacas de coelho submetidas a lesão por superdistensão de um balão de angioplastia, foi constatada uma superexpressão da PDI durante a reparação vascular. O aumento da expressão da proteína no local, 14 dias após a lesão, foi de cerca de 25 vezes, em comparação com o grupo controle.
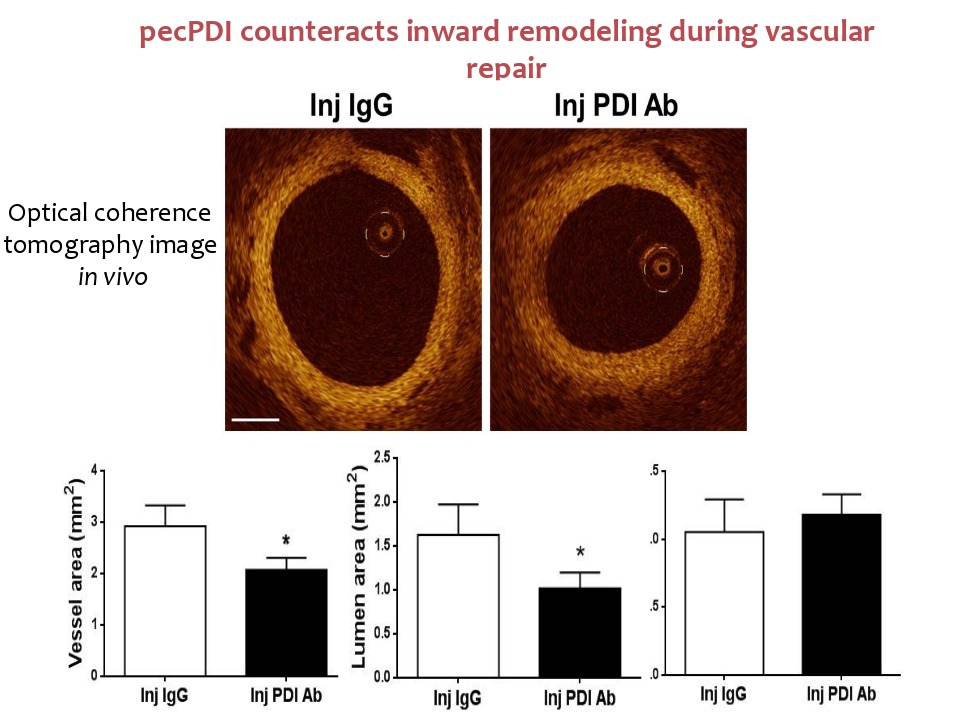
A inibição da pecPDI, por aplicação de gel perivascular contendo um anticorpo neutralizante (PDIAb) no 12º dia após a lesão, levou à perda do calibre vascular de cerca de 25% e diminuição similar na área total do vaso. O calibre foi analisado por arteriografia e a área do vaso foi detectada por tomografia de coerência óptica, método que permite ver a espessura das paredes dos vasos. Como não ocorreu alteração do tamanho da neoíntima, os dados indicam que a neutralização da pecPDI induziu a perda do calibre por remodelamento constritivo.
Ao investigarem os mecanismos envolvidos no efeito anti-remodelamento constritivo da pecPDI durante a reparação vascular, os pesquisadores concluíram que a neutralização da pecPDI provoca alterações importantes na arquitetura da matriz de colágeno e do citoesqueleto, resultando em fibras com orientação invertida e desorganizadas. E a análise de propriedades viscoelásticas nas artérias indicou redução na ductilidade (capacidade de deformação elástica sem quebra) vascular.
Os pesquisadores também investigaram o envolvimento da pecPDI em mecanoresposta, ou seja, resposta envolvendo o citoesqueleto e adaptação mecânica. Células submetidas a estiramento cíclico desenvolvem uma série de fibras de estresse. Na presença do anticorpo anti-PDI, que neutraliza a pecPDI, eles constataram uma profunda perturbação desse processo.
Segundo Laurindo, esses dados mostram o efeito da pecPDI em mecanoadaptação e sugerem um efeito geral na regulação de processos dinâmicos envolvendo o citoesqueleto celular. “Os resultados mostram que a pecPDI pode participar do remodelamento como um mediador de alterações biomecânicas que as células sofrem.”
Processos redox são integradores dos vários processos pelos quais o citoesqueleto é organizado e podem ser mediadores dos efeitos da pecPDI no remodelamento vascular. Segundo o pesquisador, um dos alvos da pecPDI seria a β1-integrina, uma proteína transmembrana que comunica a matriz e o meio extracelular com o interior da célula e é fortemente redox-regulada. De acordo com resultados obtidos, foram encontrados baixos níveis de β1-integrina reduzida na superfície celular após a neutralização da pec-PDI, reforçando a hipótese de que a β1-integrina seja um alvo. Em conjunto, estes resultados implicam, assim, um efeito dos assim-chamados “dissulfetos funcionais”, já bem conhecidos no caso da trombose intravascular, na regulação da arquitetura e calibre vascular.
O artigo Peri/Epicellular Protein Disulfide Isomerase Sustains Vascular Lumen Caliber Through as Anticonstrictive Remodeling Effect, de Leonardo Y. Tanaka, Haniel A. Araújo, Gustavo K. Hironada, Thaís L.S. Araujo, Celso K. Takimura, Andres I. Rodriguez, Anelise S. Casagrande, Paulo S. Gutierrez, Pedro Alves Lemos-Neto e Francisco R.M. Laurindo, pode ser lido por assinantes aqui
