Enzimas antioxidantes podem ser a chave para combater microorganismos patogênicos
Microorganismos patogênicos como bactérias, fungos e protozoários contam com um arsenal de enzimas antioxidantes para combater o estresse oxidativo. Isso porque animais e plantas se defendem de infecções causadas por esses patógenos gerando oxidantes derivados do oxigênio e do nitrogênio, dentre os quais hidroperóxidos, como peróxido de hidrogênio (água oxigenada), peroxinitrito e hidroperóxidos orgânicos. Peroxirredoxinas (Prxs), enzimas presentes em todos os seres vivos, são especializadas em decompor esses hidroperóxidos, protegendo as células contra danos oxidativos. No caso de infeções, protegendo os organismos invasores. Inibidores específicos para as peroxirredoxinas desses microorganismos poderiam, desta forma, representar uma nova abordagem terapêutica para superar a crescente resistência de patógenos aos antibióticos e antifúngicos.
Para sistematizar o conhecimento sobre peroxirredoxinas de patógenos, o professor Marcos Antonio de Oliveira, da Universidade Estadual Paulista Júlio de Mesquita Filho (UNESP) e do CEPID Redoxoma, e seu grupo descreveram, em um artigo de revisão, vários aspectos dessas enzimas, como abundância, diversidade de substratos e peculiaridades estruturais e funcionais, mostrando que algumas classes estão presentes apenas em microorganismos, enquanto outras têm diferenças estruturais em relação às isoformas do hospedeiro. Segundo os autores, as características intrínsecas dessas proteínas podem auxiliar no desenvolvimento de novos fármacos antimicrobianos. O artigo, escrito em colaboração com o grupo do professor Luis Eduardo Soares Netto, do Instituto de Biociências da USP e do CEPID Redoxoma foi publicado na revista Applied Microbiology and Biotechnology.
“O que acho bastante interessante é que havia uma lacuna — você tem seis classes dessas enzimas e não tinha uma abordagem do papel de cada uma das classes na resposta às defesas oxidativas/nitrosativas do hospedeiro, localização celular, sistemas redutores, virulência de microorganismos, antibióticos, ou mesmo qual é o substrato natural para cada classe. Nosso objetivo foi trazer essas informações de forma estruturada e organizada, para estimular a pesquisa nessa área”, afirmou o pesquisador.
Especialista na determinação da estrutura cristalográficas de proteínas antioxidantes, Oliveira tem investigado moléculas com potencial de inibir as peroxirredoxinas. Em conjunto com outros grupos de pesquisa, Oliveira e Netto têm um pedido de patente depositado para o uso de Adenantina, obtida de um composto natural de origem chinesa, como inibidor de peroxirredoxinas bacterianas. A Adenantina tem eficácia de três a trinta vezes maior nas Prxs de bactérias do que em proteínas humanas e também potencializa a ação de antibióticos. Além disso, “baseados nesses resultados, estabelecemos uma colaboração com os pesquisadores João Henrique Ghilardi Lago e Rodrigo Luiz Oliveira Rodrigues Cunha (CCNH — UFABC) e Marcos H. Toyama, UNESP (CLP), especialistas na purificação de compostos naturais e interação entre enzimas e inibidores, e já identificamos dois novos compostos da biodiversidade do Brasil com propriedades inibitórias sobre as Prx. Para um deles as taxas de inibição são tão grandes quanto as do composto chinês, sendo capaz de inibir a enzima e matar as bactérias”, afirmou.
Para avaliar a toxicidade dos compostos, os pesquisadores agora pretendem avançar com testes em células humanas do sistema de defesa, em conjunto com os grupos da professora Flávia Meotti, do IQ-USP e também do CEPID Redoxoma, e do professor Marcelo Brocchi, da UNICAMP, que foram atrasados por causa da pandemia. Estas pesquisas também contaram com o apoio da FAPESP por meio de auxílio regular.
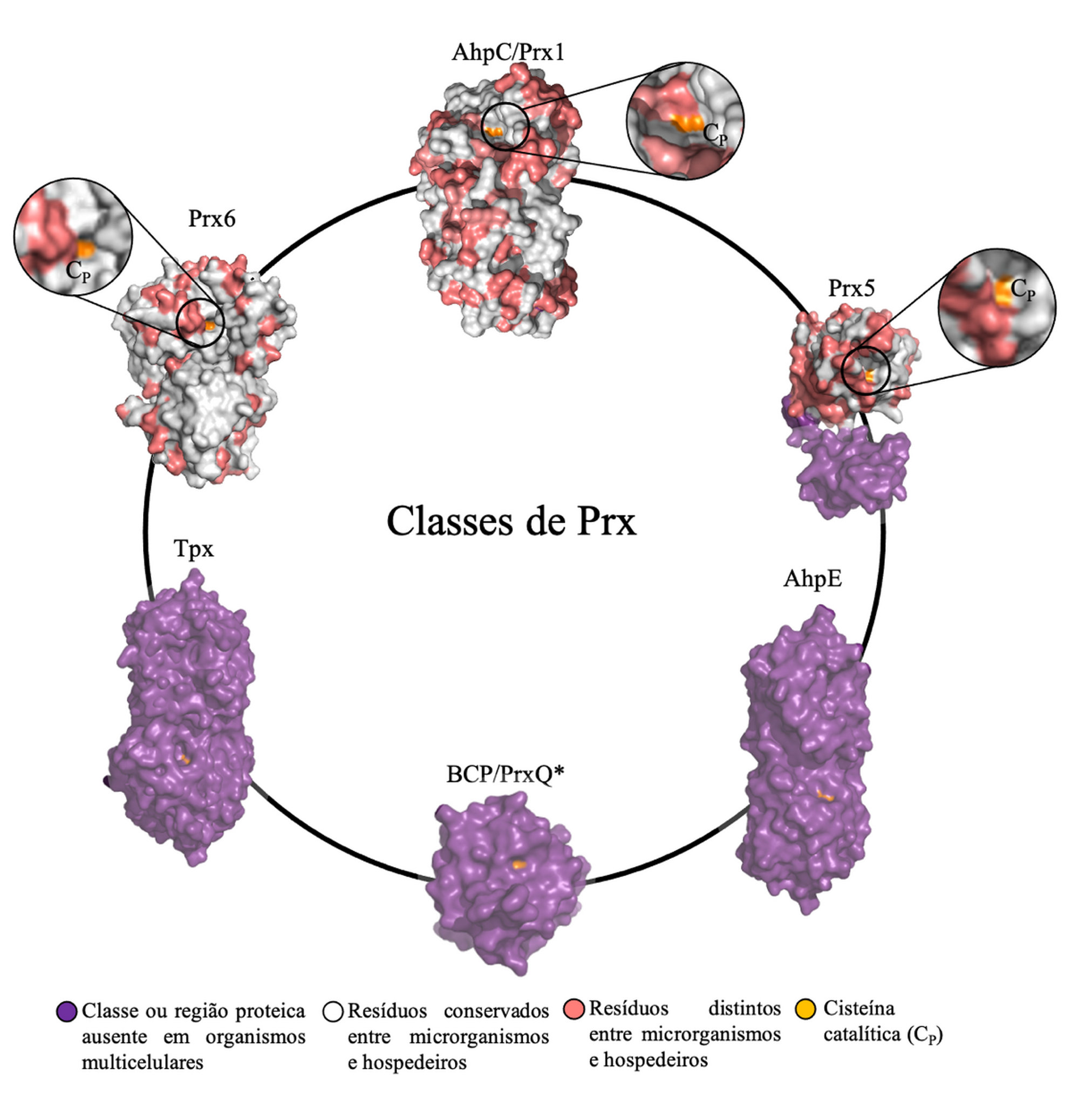
Peroxirredoxinas
As peroxirredoxinas são proteínas versáteis, fundamentais para a homeostase celular e para a sinalização redox, com funções de antioxidantes, de sensores de peróxidos e de chaperonas moleculares. São tiol-proteínas classificadas em seis classes diferentes (Prx1-AhpC, BCP-PrxQ, Tpx, Prx5, Prx6 e AhpE), com base em características estruturais e bioquímicas. Elas catalisam com alta eficácia a redução de peróxido de hidrogênio, hidroperóxidos orgânicos e peroxinitrito. A sequência de aminoácidos de sua tríade catalítica contendo uma cisteína peroxidásica (CP), uma arginina e uma treonina (ou serina, em algumas espécies) é altamente conservada em todos os seres vivos, de bactérias a humanos.
Elas estão amplamente distribuídas em diversos compartimentos celulares, como citosol, núcleo, mitocôndrias e membranas. Segundo Oliveira, em alguns microorganismos, as Prxs são muito abundantes. “Em Saccharomyces cerevisiae, uma levedura muito estudada, a soma das enzimas antioxidantes mais conhecidas (as glutationa peroxidases e as catalases) é mais ou menos um trigésimo da quantidade das Prxs”. Elas também foram detectadas em biofilmes, que conferem resistência a bactérias e fungos contra as defesas imunológicas do hospedeiro e as drogas antimicrobianas. Além de biofilmes, isoformas de Prx são secretadas para o meio extracelular e algumas são encontradas na superfície das células de bactérias, fungos e protozoários. Este é um aspecto, ainda pouco investigado, que pode ser importante para o desenvolvimento de testes diagnósticos e vacinas.
Em bactérias, são encontradas de três a dez isoformas da enzima, representando algumas das proteínas mais abundantes nesses organismos. O número de isoformas também é elevado em microorganismos eucariontes, atingindo até seis isoformas em fungos e de três a cinco em protozoários.
Mesmo com essa abundância, a expressão de Prx pode ser ainda aumentada em resposta ao estresse oxidativo promovido pelos sistemas de defesa do hospedeiro, por tratamento com hidroperóxidos ou por antibióticos. Em consequência, algumas isoformas têm sido descritas como fatores de virulência. Oliveira explica que, nas três classes de microorganismos estudados — bactérias, fungos e protozoários –, a deleção de genes que codificam Prxs torna os patógenos mais suscetíveis à morte, seja pela ação do sistema imune do hospedeiro seja por microbicidas, indicando o papel das proteínas na virulência.
Por toda sua diversidade e pelas diferenças estruturais entre as isoformas encontradas em microorganismos patogênicos e hospedeiros (mamíferos e plantas), as Prxs são alvos importantes para drogas. Segundo os pesquisadores, a identidade entre as sequências de aminoácidos das isoformas das Prxs microbianas e de hospedeiros varia de 35 a 60%.
“Fazemos ciência básica para entender os mecanismos pelos quais a enzima funciona. É fundamental conhecer a estrutura cristalográfica, para estudar as interações de ligantes no sítio ativo. Se tenho a estrutura, posso fazer algumas simulações de computador para entender qual seria o melhor ligante e depois testar em laboratório”, explica Oliveira. No entanto, o pesquisador conclui que ainda são necessários muitos estudos, com mais grupos de microorganismos. “Faltam estudos comparativos de inibidores, falta principalmente descobrir quais são os substratos naturais dessas proteínas dentro das células, pois talvez mimetizando esses compostos a gente tenha mais sucesso com os inibidores.”
O artigo Relevance of peroxiredoxins in pathogenic microorganisms, de Marcos Antonio de Oliveira, Carlos A. Tairum, Luis Eduardo Soares Netto, Ana Laura Pires de Oliveira, Rogerio Luis Aleixo-Silva, Vitoria Isabela Montanhero Cabrera, Carlos A. Breyer e Melina Cardoso dos Santos, pode ser lido aqui.