Toxina produzida pela Pseudomonas aeruginosa é capaz de combater linhagens da bactéria resistentes a antibióticos
Em situações de estresse, quando competem por nutrientes, bactérias produzem toxinas que matam outras bactérias. Essas moléculas, chamadas de bacteriocinas, podem ser uma alternativa terapêutica para o tratamento de infecções causadas por microrganismos multirresistentes — aqueles que não respondem aos antibióticos disponíveis. As piocinas são toxinas produzidas pela bactéria Pseudomonas aeruginosa. Dentre elas, a piocina S8 tem uma potente atividade bactericida contra linhagens multirresistentes. Para compreender o mecanismo pelo qual essa molécula causa a morte celular, pesquisadores liderados pelo professor Luis E. S. Netto, do Instituto de Biociências da USP e membro do CEPID Redoxoma, fizeram a caracterização bioquímica, microbicida e estrutural da piocina S8.
“A OMS (Organização Mundial da Saúde) divulgou uma lista com as famílias de bactérias que representam a maior ameaça para a saúde humana, e linhagens de Pseudomonas aeruginosa resistentes aos carbapenêmicos estão no nível crítico de prioridade para o desenvolvimento de novos antibióticos. A piocina S8 pode ser uma alternativa para tratar infecções causadas por bactérias resistentes a antibióticos”, afirmou a pós-doutoranda Helena Turano, primeira autora do artigo publicado no Journal of Bacteriology.
A Pseudomonas aeruginosa é uma bactéria oportunista capaz de colonizar uma variedade ampla de hospedeiros. Em humanos, esse patógeno é comumente encontrado em feridas causadas por queimaduras, em infecções do trato urinário e em doenças pulmonares obstrutivas, comuns em pacientes com fibrose cística. Ela é facilmente encontrada e disseminada no ambiente hospitalar, sendo um problema sério para pacientes imunocomprometidos.
Diferentemente dos antibióticos, as piocinas são proteínas e têm um espectro de ação específico, ou seja, elas têm atividade contra linhagens filogeneticamente relacionadas à da célula produtora. “A piocina produzida pela P. aeruginosa tem a capacidade de matar outra cepa da P. aeruginosa e não uma E. coli, por exemplo. Isso significa que o uso de piocinas tem também a vantagem de não interferir na microbiota do hospedeiro, melhorando a saúde do paciente e aumentando a eficácia do tratamento”, afirmou a pesquisadora, que começou a estudar essas toxinas durante seu doutorado, realizado no Instituto de Ciências Biológicas da USP, sob orientação do professor Nilton Lincopan, um dos coautores do trabalho. Ela identificou uma piocina que tinha atividade potente contra cepas multirresistentes da P. aeruginosa e, ao fazer o sequenciamento do genoma, descobriu que era a S8. “Essa piocina só havia sido descrita por análise in silico, ou seja, por simulação computacional. Foi a primeira vez que ela foi testada in vivo”.

Estrutura e Mecanismo
Existem três tipos de piocinas, classificadas de acordo com sua estrutura como R, F e S. As duas primeiras são complexos de alto peso molecular e as do tipo S, que foram o foco desta pesquisa, são moléculas de baixo peso molecular, constituídas por apenas duas subunidades proteicas. O componente maior é o que mata as células alvo e o menor confere imunidade à célula produtora da piocina ao se ligar ao componente maior e inibir sua atividade, impedindo que a bactéria que produz a toxina seja eliminada por ela.
Os pesquisadores descreveram a estrutura da piocina S8 por cristalografia de raio X, com resolução de 1,38 Å. Também fizeram a caracterização bioquímica da molécula, o que envolveu avaliar a atividade DNase de seu domínio citotóxico. “Essa atividade de DNase é não específica, ou seja, ao entrar na célula alvo, a enzima irá clivar o DNA em vários locais, pois ela é uma DNase que não possui especificidade de sequência.. Isso acarretará a morte celular, pois a célula não consegue lidar com essas inúmeras lesões na molécula do DNA”, explica Fernando Gomes, que é pós-doutorando no mesmo laboratório e coautor do artigo.
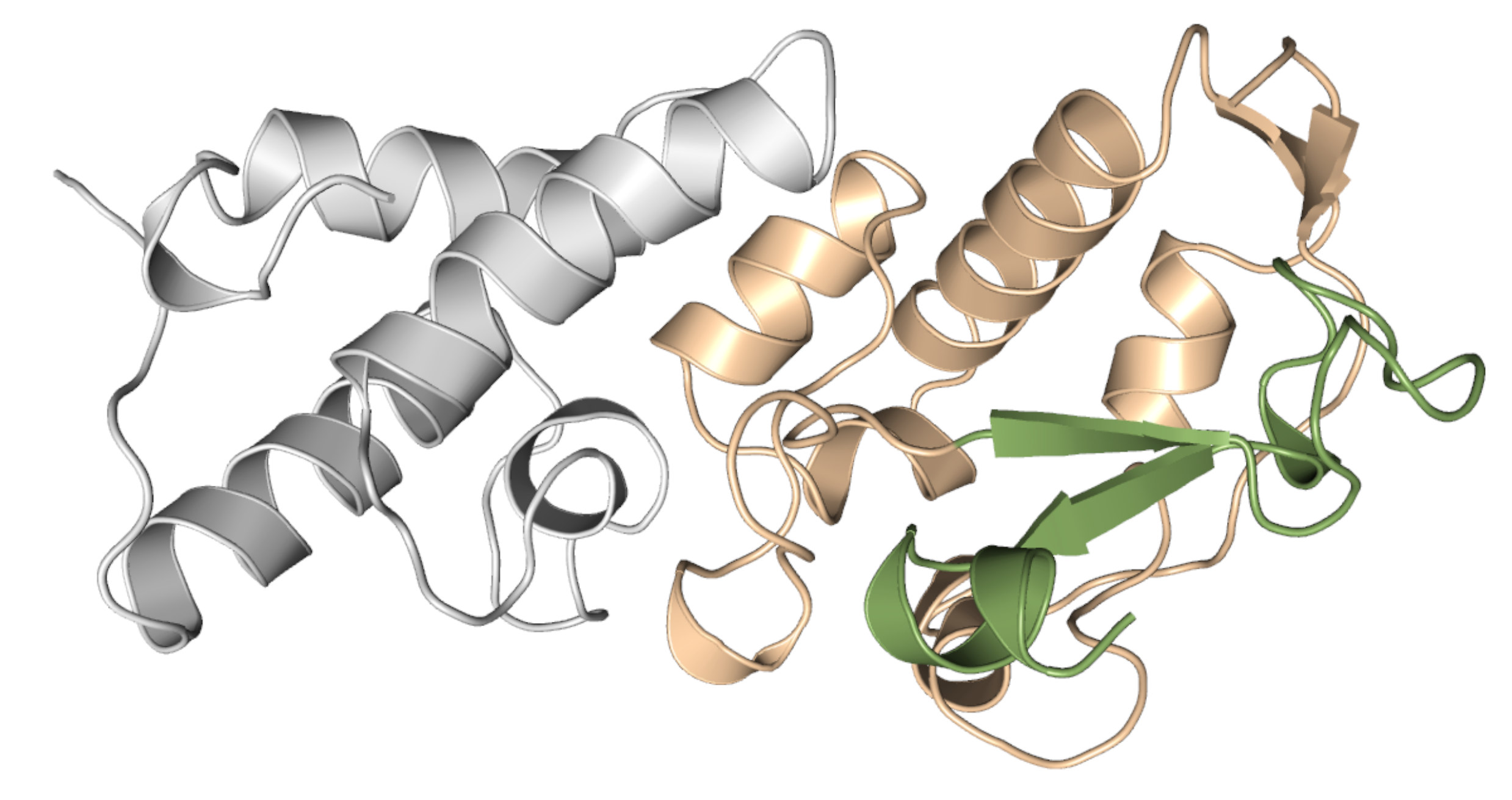
A atividade DNase depende de um cofator enzimático, no caso um metal, um cátion divalente. O metal se liga na enzima por quatro resíduos de histidina altamente conservados, que compõem o motivo H-N-H da molécula. Para caracterizar a afinidade de ligação da enzima com diferentes metais, os pesquisadores usaram a técnica de Isothermal titration calorimetry (ITC), em parceria com o grupo do professor Cristiano L. P. Oliveira, do Instituto de Física da USP. Eles concluíram que a enzima se liga com uma afinidade alta ao níquel e ao zinco, sendo que o primeiro induz a atividade DNase e o segundo a inibe.
Um achado importante do estudo foi que o aminoácido glutamato, que é um resíduo altamente conservado do motivo H-N-H, é fundamental para a atividade catalítica. “Estudos anteriores com as colicinas (as toxinas produzidas por Escherichia coli) demonstraram que o resíduo de glutamato forma uma interação com uma arginina. Foi demonstrado que essa interação é importante para distorcer a molécula do DNA e aproximar o esqueleto fosfodiéster ao sítio ativo da enzima, permitindo a clivagem. No entanto, até o momento, não há nenhuma estrutura cristalográfica das piocinas em complexo com o DNA e, portanto, estamos trabalhando para isso”, afirmou Gomes.
Os pesquisadores ressaltam que o motivo que liga o metal nessas enzimas, o H-N-H, está amplamente distribuído na natureza. Várias enzimas do metabolismo do DNA, como as que atuam na recombinação homóloga e no reparo de DNA, possuem esse motivo H-N-H. “Entender como esse motivo funciona trará um embasamento para o entendimento de outras enzimas importantes em biologia. Isso é uma contribuição bem importante desse trabalho”, afirmaram.
No entanto, segundo os pesquisadores, o grande potencial dessas moléculas pode ser reduzido caso as bactérias desenvolvam resistência à piocina. Por isso a importância de compreender os mecanismos moleculares pelos quais as piocinas matam as células-alvo. “Um dos objetivos nossos agora é tentar resolver a estrutura da molécula complexada com o DNA”, adiantam os pesquisadores.
Em colaboração com outros pesquisadores, os quais cederam uma coleção de cepas de bactérias multirresistentes, Helena pretende fazer ensaios pré-clínicos para descobrir qual é a concentração mínima de piocina S8 necessária para matar as bactérias. O passo seguinte será realizar ensaios com animais. “Infelizmente demos uma parada com a pandemia, mas a ideia é que quando pudermos retomar uma normalidade isso possa ser efetivado”, conclui a pesquisadora.
O artigo Molecular structure and functional analysis of pyocin S8 from Pseudomonas aeruginosa reveals the essential requirement of a glutamate residue in the H-N-H motif for DNase activity, de Helena Turano, Fernando Gomes, Renato M. Domingos, Maximilia F. S. Degenhardt, Cristiano L. P. Oliveira, Richard C. Garratt, Nilton Lincopan e Luis E. S. Netto, pode ser lido aqui.
