Novo estudo comprova papel da vitamina C em via alternativa de defesa antioxidante
Todas as células contêm sistemas de defesa antioxidante, para evitar danos químicos aos seu componentes. Dentre esses sistemas, as peroxirredoxinas são consideradas as principais enzimas detoxificadoras de peróxidos, como o peróxido de hidrogênio (H2O2, a água oxigenada), um oxidante continuamente produzido em nosso organismo. Para manter a atividade antioxidante, as peroxirredoxinas precisam ser recicladas por redutores, geralmente tióis. Tióis (moléculas contém o grupo –SH) são compostos derivados de enxofre e são centrais na fisiologia redox. No entanto, o ascorbato, ou vitamina C (que não apresenta átomos de enxofre = S), também pode reciclar essas enzimas, reduzindo o ácido sulfênico (R-SOH), que é o produto inicial da oxidação de tióis por peróxidos. Agora, pesquisadores determinaram as constantes de velocidade da reação entre o ascorbato e o ácido sulfênico em diversas proteínas, o que é importante para investigar a relevância biológica dessa via redox independente de tiól.
“Muito processos centrais em biologia, como síntese de precursores de DNA, envolvem reações redox entre moléculas que contêm enxofre, como tióis (R-SH), ácidos sulfênicos (R-SOH) e dissulfetos (R-SS-R). Nós estamos propondo um novo mecanismo pelo qual o ascorbato pode interagir com moléculas que contêm enxofre. Isso é uma outra interface, pela qual moléculas que contêm enxofre (S) podem conversar com outros sistemas via ascorbato. O ascorbato por sua vez está envolvido em uma série de outros processos, como síntese de colágeno. Essa reação de ascorbato com ácido sulfênico serve como uma nova via para o metabolismo redox”, afirmou o professor Luis E. S. Netto, do Instituto de Biociências da USP e membro do CEPID Redoxoma, coordenador da pesquisa publicada na revista Free Radical Biology and Medicine (FRBM).
Os ácidos sulfênicos são gerados nos resíduos de cisteína do sítio ativo das peroxirredoxinas, que são uma família de enzimas antioxidantes presente em todos os seres vivos. As células de mamíferos expressam seis formas dessa enzima, classificadas como 2-Cys e 1-Cys, de acordo com o número dos resíduos de cisteína que participa da catálise. Em ambos os casos, as reações das peroxirredoxinas com peróxidos gera ácido sulfênico na cisteína reativa (veja figura abaixo). Nas 2-Cys peroxirredoxinas, o ácido sulfênico forma um dissulfeto com outra cisteína catalítica, que então é reduzido por um tiól biológico, a tiorredoxina, fechando o ciclo catalítico — a enzima volta à forma inicial e o ciclo recomeça. No caso das 1-Cys peroxirredoxinas, como existe apenas uma cisteína, o ácido sulfênico não pode formar dissulfeto. As 1-Cys peroxirredoxinas são menos estudadas e as identidades de seus redutores biológicos não são claras.
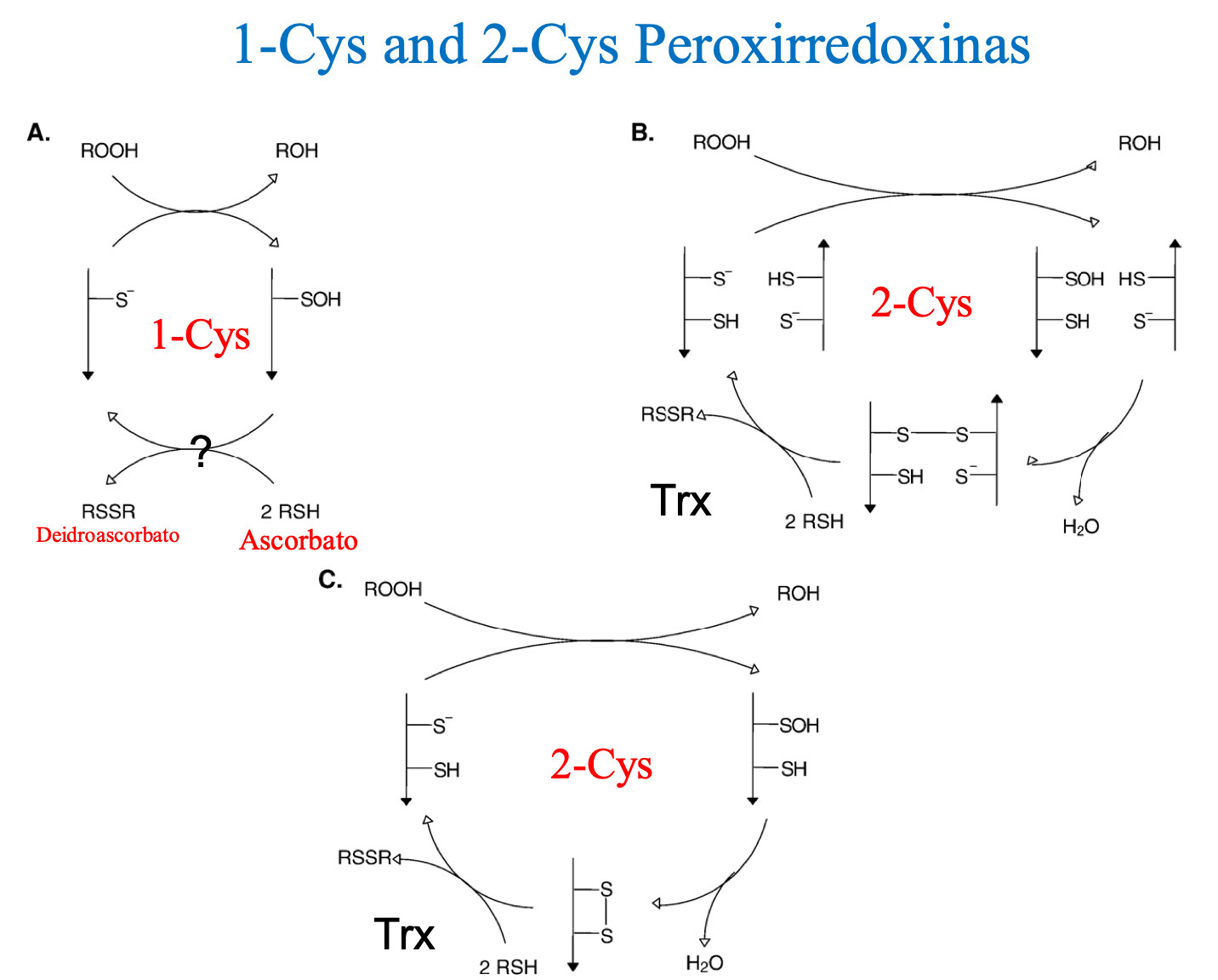
Em 2007, Netto e seu grupo mostraram que o ascorbato reduz o ácido sulfênico de 1-Cys peroxirredoxinas, desafiando o paradigma segundo o qual a atividade antioxidante destas enzimas dependia unicamente da reciclagem por tióis. O trabalho foi publicado no PNAS e teve grande repercussão, por ter revelado uma nova função da vitamina C. No entanto, o pesquisador sempre afirmou que seria necessário determinar a velocidade em que o processo ocorre, para avaliar sua relevância biológica. “O trabalho atual é um desdobramento do estudo de 2007. Vimos agora que essa reação tem uma constante de velocidade moderada. Isso indica que a redução de ácidos sulfênicos de proteínas pode ser relevante em compartimentos biológicos onde a concentração de ascorbato é alta.”
Segundo Netto, uma evidência da importância dessa reação in vivo foi fornecida por um estudo internacional feito com camundongos mutantes que desenvolveram fenótipo semelhante ao escorbuto, que é uma doença causada por carência de vitamina C, levando a hemorragias, alteração das gengivas e queda da resistência às infecções. De acordo com os autores do estudo, esses animais apresentavam escorbuto por um mecanismo diferente. Suas células apresentaram alta concentração de ácido sulfênico, que consumia o ascorbato, provocando uma doença com características similares ao escorbuto clássico. Esse também é um exemplo de que a redução de ácidos sulfênicos pelo ascorbato em proteínas pode ocorrer em proteínas distintas de 1-Cys peroxirredoxinas.
Para calcular as velocidades das reações entre o ascorbato e os ácido sulfênicos das proteínas, os pesquisadores fizeram um ensaio de competição usando um composto chamado DCPIP (diclorofenolindofenol) como oxidante concorrente. O método foi desenvolvido para esse estudo pelo pesquisador Gerardo Ferrer-Sueta, da Universidad de La República, em Montevidéu, Uruguai, coautor do artigo. Os resultados obtidos pela então aluna de doutorado Valesca Anschau indicaram constantes de velocidade na faixa de 0,4–2,2 × 103 M-1 s-1.
Plantas, fungos e bactérias
Este mecanismo também pode ter grande importância em plantas, fungos e bactérias. Em humanos, as 1-Cys peroxirredoxinas podem ser reduzidas por sistemas diferentes que competem entre si, sendo difícil atribuir a relevância do ascorbato na reciclagem dessas enzimas. Mas em organismos como plantas, fungos e bactérias, a redução por ascorbato é o único mecanismo demonstrado para essas 1-Cys peroxirredoxinas até o momento.
Nas plantas, as 1-Cys peroxirredoxinas estão localizadas no núcleo das células das sementes. No geral, plantas têm níveis bastante altos de ascorbato, o qual tem sido relacionado ao desenvolvimento, envelhecimento e germinação das sementes. “Estamos estudando esse mecanismo em plantas. Acreditamos que a 1-Cys peroxirredoxina e o ascorbato tenham um papel importante na germinação de sementes”, afirmou Netto.
Em bactérias, a 1-Cys peroxirredoxina está envolvida na virulência. “Publicamos um trabalho em colaboração com o grupo da professora Regina Baldini, em que mostramos que, se você tira o gene que codifica essa peroxirredoxina da Pseudomonas aeruginosa, ela deixa de ser virulenta em camundongos,” conta o pesquisador. E o único redutor dessa enzima é o ascorbato.
Igualmente, fungos patogênicos do gênero Aspergillus possuem três 1-Cys peroxirredoxinas e até o momento o único redutor proposto para elas é o ascorbato.
O artigo Reduction of sulfenic acids by ascorbate in proteins, connecting thiol-dependent to alternative redox pathways, de Valesca Anschau, Gerardo Ferrer-Sueta, Rogerio Luis Aleixo-Silva, Renata Bannitz Fernandes, Carlos A. Tairum, Celisa Caldana Costa Tonoli, Mario Tyago Murakami, Marcos Antonio de Oliveira e Luis Eduardo Soares Netto, pode ser lido aqui.
