Estudo detalha mecanismo de ação de proteína antioxidante de bactérias
Pesquisadores liderados pelo professor Luis Eduardo Soares Netto, do Instituto de Biociências da USP e membro do CEPID Redoxoma, descreveram seis estruturas cristalográficas da proteína Ohr do patógeno oportunista Chromobacterium violaceum, incluindo a estrutura do complexo entre a Ohr e seu substrato biológico, a dihidrolipoamida (DHL), e analisaram as mudanças estruturais durante o ciclo catalítico da enzima. A Ohr é uma enzima antioxidante presente principalmente em bactérias e fungos, alguns deles patogênicos, que protege estes microrganismos contra danos oxidativos. O estudo, publicado na revista ACS Catalysis, foi realizado durante o doutorado de Renato Mateus Domingos, primeiro autor e coautor correspondente do artigo, e pode facilitar o desenvolvimento de um inibidor da enzima.
“Usamos diversas abordagens, como cristalografia, dinâmica molecular computadorizada e cinética para descrever o nosso modelo, com foco na fase da redução no ciclo catalítico da Ohr, que era a menos conhecida. A estrutura do complexo da enzima com seu substrato redutor serviu de base para as modelagens de simulação teórica. Conhecendo o mecanismo enzimático é mais fácil — ou menos difícil — desenhar inibidores para a Ohr”, afirmou Luis Netto. Como não existem enzimas semelhantes em mamíferos ou plantas, esta enzima se torna um alvo atraente para o desenvolvimento de medicamentos. A identificação de inibidores desta enzima também seria importante para a agricultura, na medida em que ela já foi encontrada em patógenos — bactérias e fungos — que atacam plantas.
As relações entre patógenos e hospedeiros são complexas e foram moduladas durante o processo evolutivo. Quando são invadidos por microrganismos patogênicos, plantas e animais disparam uma resposta inflamatória, com geração de oxidantes, dentre os quais os hidroperóxidos derivados de ácidos graxos. As bactérias, por sua vez, “contra-atacam” com um arsenal de enzimas para decompor esses oxidantes. A Ohr é uma das enzimas que desempenha papel central na resposta bacteriana a oxidantes (hidroperóxidos de ácidos graxos e a peroxinitrito). Por esse motivo, proteínas Ohr têm sido associada à virulência de várias bactérias, como Pseudomonas aeruginosa, Chromobacterium violaceum e Bacillus cereus.
Superbactérias, ou microrganismos resistentes a múltiplas drogas (MDR, multi-drug resistant microorganisms), são uma ameaça mundial à saúde pública. A Organização Mundial de Saúde vem alertando que podemos estar caminhando para uma era pós-antibiótico, na qual infecções comuns e ferimentos leves podem voltar a matar. Por isso, a identificação de novos alvos para o desenvolvimento de tratamentos antimicrobianos é de urgência global.
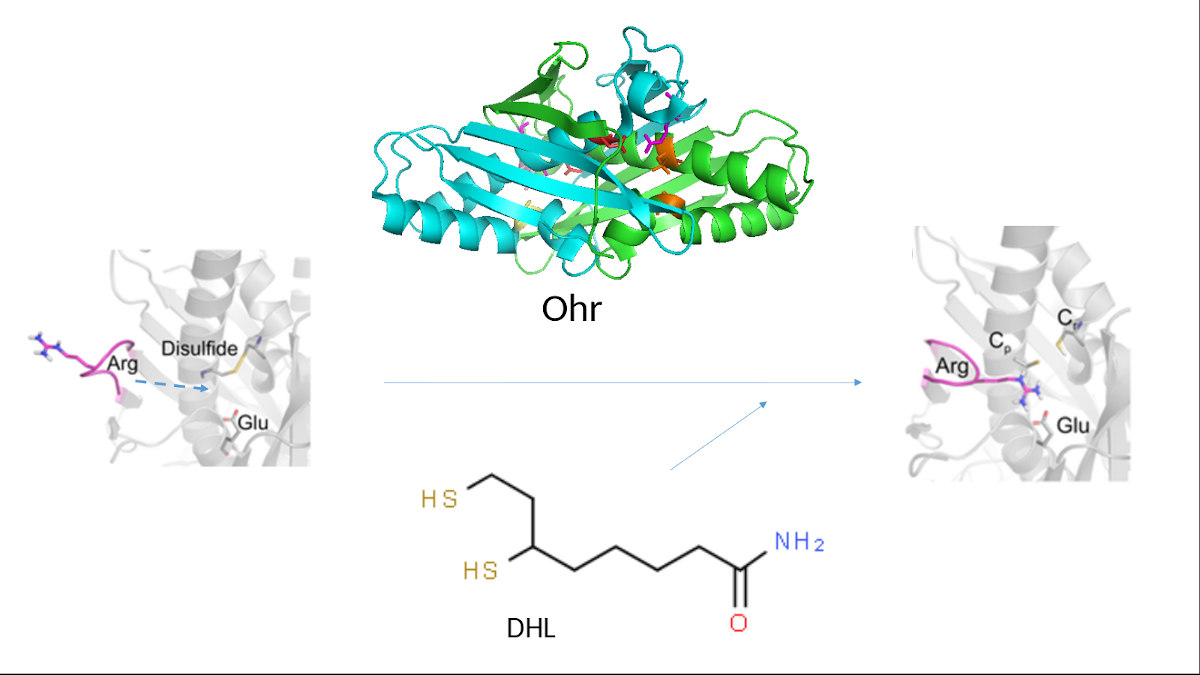
Mecanismo catalítico
“A Ohr é uma enzima capaz de acelerar a reação de decomposição de peróxidos por um fator de um milhão de vezes em relação à reação não catalisada. Para entender essa grande eficiência era muito importante conhecer intermediários da catálise, o que conseguimos a partir das estruturas que o Renato descreveu”, afirmou Luis Netto.
Estruturas cristalográficas são como fotografias, mostram um momento estático, explica o pesquisador. Mas as proteínas, para desempenhar seu papel, estão em constante movimento, como num filme. Para se visualizar o ciclo catalítico de uma enzima são necessárias muitas fotos — como naquele antigo processo de animação em que uma sequência de desenhos passada em velocidade dava a impressão de movimento.
Para determinar as estruturas descritas no estudo, foram necessárias várias etapas, começando pela clonagem do gene da Ohr. Em seguida, os pesquisadores obtiveram grandes quantidades da proteína usando a bactéria E. coli, que recebeu o gene com as instruções moleculares para produzir a proteína Ohr. Depois disso, foi preciso purificar a Ohr, separando-a das demais proteínas da E. coli. Como a proteína purificada estava em solução, o passo seguinte foi formar os cristais. Tal como o sal usado para cozinhar, as moléculas de proteínas têm capacidade de se organizar em estado sólido, os cristais. Estes cristais foram posteriormente levados para Laboratórios de luz síncrotron, neste caso o Síncrotron da Universidade de Stanford — Stanford Synchrotron Radiation Light source (SSRL) — e o Laboratório Nacional de Luz Síncrotron em Campinas (LNLS), onde foram submetidos ao raio-X, que produziu padrões de difração, fornecendo informações para determinar as estruturas da Ohr, inclusive a estrutura que apresenta a DHL ligada a ela. Por meio de cálculos matemáticos, os pesquisadores determinaram as densidades eletrônicas, que permitiram a modelação dos grupos químicos que constituem a estrutura tridimensional da enzima. A validação dessas estruturas foi feita em colaboração com o grupos dos pesquisadores Raphael D. Teixeira e Shaker Chuck Farah, do Instituto de Química da USP, e Plínio S. Vieira e Mario Murakami, do Laboratório Nacional de Biociências (LNBio) do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM).
Os pesquisadores também compararam as estruturas que obtiveram com outras 10 estruturas de Ohr disponíveis no PDB (Protein Data Bank), confirmando os resultados e o ciclo catalítico proposto. “Quanto mais estruturas de uma mesma proteína estiverem disponíveis no banco de dados, mais consistência terão os modelos propostos. Nosso trabalho aumentou consideravelmente a quantidade de estruturas de Ohr disponível. Isso possibilita fazer análises com mais segurança”, disse Netto.
Com o objetivo de entender o mecanismo catalítico da Ohr a partir das estruturas, os pesquisadores utilizaram diversas abordagens de modelagem molecular computadorizada, como simulações de mecânica clássica (MM), dinâmica molecular dirigida (SMD) e mecânica quântica híbrida (QM-MM), em colaboração com o grupo do pesquisador Dario A. Estrin, da Universidad de Buenos Aires. Estas simulações, em conjunto com ensaios experimentais com mutações pontuais na Ohr, revelaram que os substratos e produtos da reação catalítica facilitam as mudanças conformacionais essenciais para a atividade da Ohr, acelerando assim o seu ciclo catalítico . Segundo os pesquisadores, os resultados evidenciam que a DHL é um redutor biológico da Ohr. Além disso, expandem o conceito de catálise assistida por substrato e produto para um nova classe de enzimas, as proteínas Ohr.
O artigo Substrate and product-assisted catalysis: molecular aspects behind structural switches along Organic Hydroperoxide Resistance Protein catalytic cycle, de Renato M. Domingos, Raphael D. Teixeira, Ari Zeida, William A. Agudelo, Thiago G.P. Alegria, Jose F. da Silva Neto, Plínio S. Vieira, Mario T. Murakami, Chuck S. Farah, Dario A. Estrin e Luis E.S. Netto, pode ser lido aqui.
