Cientistas descobrem mecanismo que impede morte celular por ferroptose e torna células cancerosas mais resistentes
Em artigo publicado na revista Nature, cientistas descreveram como o acúmulo de 7-dehidrocolesterol (7-DHC), um lipídio precursor do colesterol, suprime a morte celular por ferroptose e pode favorecer a sobrevivência de células cancerosas. A ferroptose é uma forma de morte celular caracterizada pelo acúmulo letal de produtos da peroxidação lipídica e catalisada por íons de ferro. Ela vem sendo explorada para eliminar tumores resistentes a outros tipos de morte celular. Os pesquisadores identificaram uma atividade pró-ferroptose da 7-dehidrocolesterol redutase (DHCR7), a última enzima na via da biossíntese do colesterol, e uma inesperada função pró-sobrevivência do seu substrato, o 7-DHC.
O estudo foi liderado pelo cientista brasileiro José Pedro Friedmann Angeli, atualmente na University of Würzburg, na Alemanha, e contou com a colaboração dos pesquisadores do CEPID Redoxoma Sayuri Miyamoto, do Instituto de Química da USP, e Luis E.S. Netto, do Instituto de Biociências da USP, e seus grupos, além de pesquisadores da Alemanha, Estados Unidos e Canadá.
“Nesse trabalho, conseguimos mostrar várias coisas importantes. Uma delas é que para que ocorra morte celular é necessária a oxidação de fosfolipídios e não de qualquer lipídio. Como descobrimos esse efeito protetor do 7-DHC, vimos que, estimulando a peroxidação lipídica, há mais radicais livres indo para a membrana, mas, desde que eles não cheguem ao fosfolipídio, não vai ter morte celular. Isso é importante como mecanismo. Outro aspecto é que já se sabia que o 7-DHC é tóxico para neurônios, mas mostramos que esse metabólito, quando acumulado, gera um fenótipo mais agressivo em tumores,” afirmou Angeli.
Além disso, os autores alertam para o fato de haver uma série de medicamentos capazes de inibir a enzima DHCR7 aprovados pelo FDA (a agência de vigilância sanitária dos Estados Unidos), como, por exemplo, a Trazodona, prescrita mais de 20 milhões de vezes por ano nos EUA, e por vezes vendida para tratar insônia sem que tenha sido aprovada para este fim. Estudos mostraram que pacientes que tomam este medicamento têm níveis plasmáticos aumentados de 7-DHC. Segundo os autores, serão necessários estudos epidemiológicos para explorar se existem grupos de pacientes que consomem regularmente medicamentos moduladores da ferroptose e se isso tem algum impacto na incidência de câncer, de metástases ou em outros aspectos relevantes para a saúde pública.
Mecanismo
O grupo de Angeli investiga há muitos anos os mecanismos de resistência ou sensibilidade à ferroptose em modelos genéticos e farmacológicos, que convergem na inibição da enzima glutationa peroxidase 4 (GPX4), única enzima capaz de reparar hidroperóxidos de fosfolipídios (PLOOH) oxidados. Para identificar genes que quando deletados possam conferir proteção contra ou induzir a ferroptose, os pesquisadores utilizaram uma biblioteca de CRISPR knockout e submeteram um pool de células com genes inativados ao processo de ferroptose. “Ao induzir esse processo nesse pool de células onde há uma grande variabilidade genética, algumas células vão ficar mais resistentes à peroxidação lipídica, e identificamos quais são essas células. No caso desse trabalho identificamos um dos genes, o Acls4, que havíamos descrito em 2017, e é um gene essencial para a incorporação de lipídios poli-insaturados. Se você não incorpora lipídios poli-insaturados à membrana, as células não têm substrato para oxidar e estão protegidas. E o outro gene que apareceu foi o Dhcr7, que codifica a enzima DHCR7”.
Como a inibição da enzima DHCR7 leva ao acúmulo do 7-DHC, os pesquisadores geraram e estudaram uma série de linhagens celulares nocautes, nas quais modularam a concentração desse intermediário, e demonstraram que o 7-DHC tem um papel crucial na proteção celular.
A etapa seguinte foi entender o impacto desse lipídio na oxidação de fosfolipídios da membrana celular. “Trabalhamos bastante com modelos in vitro de oxidação de lipossomos [vesículas compostas de bicamadas lipídicas] e o doutorando Alex Inague realizou os experimentos que mostraram que o 7-DHC de fato protege os fosfolipídios de membrana da oxidação induzida por radicais livres gerados por íons de ferro”, afirmou Miyamoto.
Inague desenvolveu o método que permitiu aos pesquisadores montar lipossomos com diferentes esteróis, que são uma classe de lipídios que inclui o colesterol e o 7-DHC, e verificar o que acontecia com os substratos (fosfolipídios, esteróis). “O que a gente viu inicialmente foi que, como o 7-DHC está presente na membrana em maior concentração, ele se oxida muito rápido, e o fosfolipídio oxida menos. Com isso entendemos que ele estava se sacrificando na membrana”, explica Inague. Com um ensaio de estabilidade de membrana, os pesquisadores também viram que, na presença do 7-DHC, a membrana rompia menos e liberava menos o conteúdo intramembrana para o meio externo.
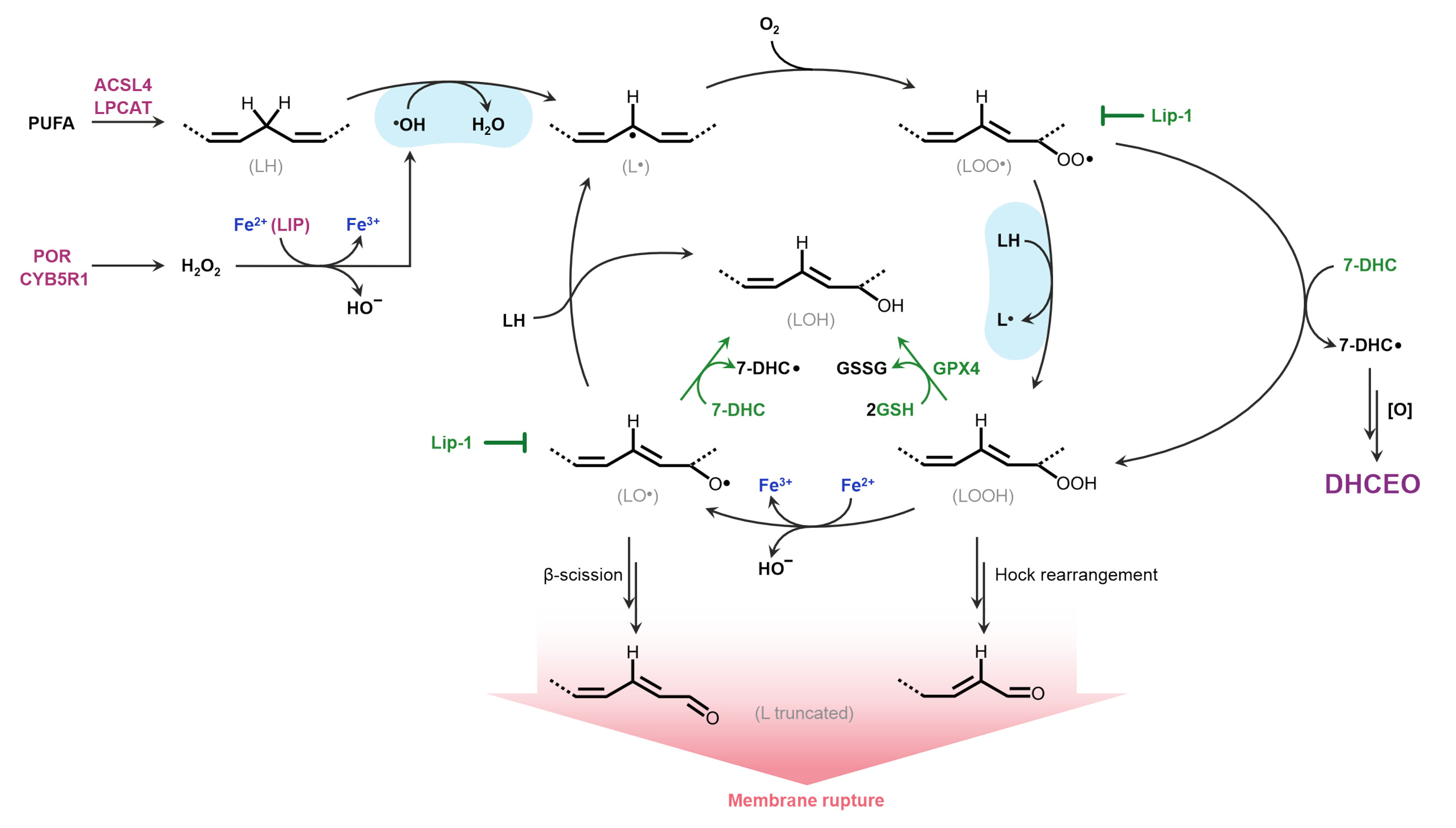
Para ter uma compreensão mais abrangente do papel dos esteróis, os pesquisadores também estudaram leveduras que acumulam ergosterol, em colaboração com o pesquisador Fernando Gomes, do grupo de Luis Netto. “O ergosterol é um esterol com uma estrutura muito semelhante à do 7-DHC - tem duas duplas ligações no anel B, assim como o 7-DHC. Verificamos que, quando as leveduras acumulam esses esteróis com duas duplas ligações, são mais protegidas contra oxidação e, quando elas não conseguem acumular esse tipo de esterol, se tornam mais sensíveis”.
Com esses resultados, os pesquisadores propuseram que o acúmulo de esteróis como o 7-DHC e o ergosterol é um mecanismo relevante de proteção das membranas contra a peroxidação de fosfolipídios em nível celular.
Ferroptose e câncer
As células cancerosas usam várias estratégias para evitar mecanismos que levam à morte celular por apoptose e para se tornarem resistentes à quimioterapia, levando ao surgimento de células tolerantes a medicamentos. Nestes casos, a indução da ferroptose poderia ser uma maneira de eliminar os tumores.
Depois de entender os fundamentos moleculares pelos quais o 7-DHC previne a ferroptose, os pesquisadores resolveram investigar se este efeito protetor poderia ter algum papel no crescimento de tumores em condições nas quais a inibição da ferroptose é crítica. Mutações raras no gene que codifica a enzima DHCR7 são encontradas em alguns tipos de câncer, como o linfoma de Burkitt e o neuroblastoma. Com base nessas informações, eles criaram modelos animais de ambos os tipos de câncer e observaram que as mutações causam perda de função da enzima e consequente acúmulo do 7-DHC.
“A gente usou dois modelos, um para linfoma e um para neuroblastoma. No modelo de linfoma, em que o tumor é injetado na circulação, vimos que de fato as células que acumulam o 7-DHC são bem agressivas, por serem mais resilientes. No modelo de neuroblastoma, vimos que, enquanto estão no tumor primário, as células crescem de maneira parecida, mas aquelas que têm a mutação e acumulam o 7-DHC são mais agressivas e mais eficientes em gerar metástase em órgãos distantes”, conta Angeli.
O próximo passo desse trabalho será investigar como vão evoluir os tumores se a produção de 7-DHC for totalmente inibida. “Às vezes durante o processo de evolução tumoral, pode haver algum tipo de modulação que não conseguimos detectar nos modelos que usamos. E vai ser importante ver como as células que são incapazes de produzir o 7-DHC vão se comportar in vivo, quando forem injetadas nesses modelos. Outra questão é como células que não conseguem acumular 7-DHC respondem frente a um quimioterápico normal. São estudos que ainda precisam ser feitos”, afirma Angeli.
O artigo 7-Dehydrocholesterol is an endogenous suppressor of ferroptosis pode ser lido aqui.
